题目内容
16.发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.已知:N2(g)+2O2(g)=2NO2(g)△H=67.7kJ•mol-1
N2H4 (g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2 (g)=HF (g)△H=-269kJ•mol-1
H2 (g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-242kJ•mol-1
①肼和NO2反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7kJ•mol-1.
②有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ•mol-1.
分析 已知:①N2(g)+2O2(g)═2NO2△H=+67.7kJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O△H=-543kJ•mol-1
③$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)═HF(g)△H=-269kJ•mol-1
④H2(g)+$\frac{1}{2}$O2(g)═2H2O△H=-242kJ•mol-1
(1)根据盖斯定律,②×2-①得气态肼和二氧化氮的反应,可计算出反应热,并书写热化学方程式;
(2)根据盖斯定律,③•4+②-④•2得气态肼和氟气反应的热化学方程式.
解答 解:已知:①N2(g)+2O2(g)═2NO2△H=+67.7kJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O△H=-543kJ•mol-1
③$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)═HF(g)△H=-269kJ•mol-1
④H2(g)+$\frac{1}{2}$O2(g)═2H2O△H=-242kJ•mol-1
①根据盖斯定律,②×2-①得气态肼和二氧化氮的反应的热化学方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1153.7KJ/mol,
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1153.7KJ/mol;
②根据盖斯定律,③•4+②-④•2得气态肼和氟气反应的热化学方程式为N2H4(g)+2F2 (g)═N2(g)+4HF (g)△H=-1135KJ/mol,
故答案为:N2H4(g)+2F2 (g)═N2(g)+4HF (g)△H=-1135KJ/mol.
点评 本题考查了盖斯定律在热化学方程式计算中的应用,题目难度中等,明确盖斯定律的含义及应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.

(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(3)丙同学利用:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定.
①设计的下列滴定方式,最合理的是b.(夹持部分略去)(填字母序号)
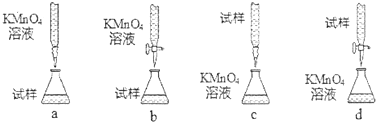
②判断滴定终点的依据是当滴下最后一滴KMnO4标准溶液时,溶液颜色变为浅紫红色,且在半分钟内不褪色.
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |