题目内容
4.明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下: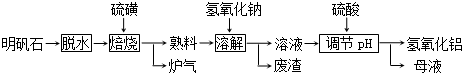
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S $\frac{\underline{\;高温\;}}{\;}$ 2Al2O3+9SO2,其中氧化剂为Al2(SO4)3.
(2)“溶解”时反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净.
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882g/L 的H2SO4,配制1L该溶液,需用量筒量取质量分数为98%的硫酸(密度是1.8g/cm3)500.0mL.
(5)“母液”中可回收的物质是K2SO4;Na2SO4.
分析 根据元素守恒和得失电子守恒,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质.
(1)所含元素化合价降低的反应物是氧化剂;
(2)“溶解”时氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)根据溶液稀释前后溶质的质量不变计算;
(5)“母液”中含有硫酸盐.
解答 解:(1)2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低到+4价,则Al2(SO4)3为氧化剂,
故答案为:Al2(SO4)3;
(2)“溶解”时氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)m(H2SO4)=882g/L×1L=882g,设需要xmL浓硫酸,则有xmL×1.8g/mL×98%=882g,x=500.0,
故答案为:500.0;
(5)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,
故答案为:K2SO4;Na2SO4.
点评 本题考查物质的制备、分离等知识,侧重于学生的分析能力和计算能力的考查,为高考常见题型,难度中等,注意把握物质的相关性质.

 阅读快车系列答案
阅读快车系列答案| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
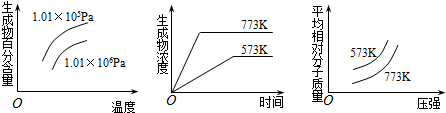
下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g) (正反应为吸热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g) (正反应为放热反应) | |
| D. | 2HI(g)?I2(g)+H2(g) (正反应为吸热反应) |
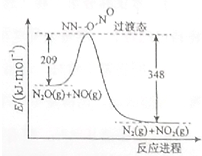 (1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.
(1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.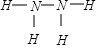 ,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.
,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.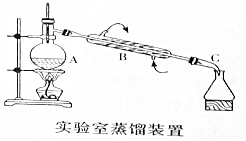 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.