题目内容
5.小林同学发现铜制眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3.提出问题:铜是在什么条件下被锈蚀的?小林对此进行了探究.
猜想:根据铜锈的化学式,猜想铜生锈可能是铜与H2O、O2、CO2作用的结果.
设计与实验:借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”.
实验如图所示.
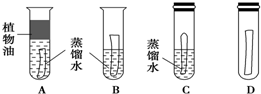
(1)实验较长时间后发现B试管中的光亮铜片最先生锈.
(2)从优化实验的角度考虑,A实验是多余的,他只考虑了水这个单一条件.C试管中除光亮铜片、蒸馏水外,还有的另外一种物质为CO2(或O2).评价与改进:如果认为小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确的结论,还要补充的一个实验是(可画图表示)铜片与水和氧(二氧化碳)接触而探究氧气(二氧化碳)对生锈的影响,设计如图
 .
.
分析 是否存在氧气和水,是普通金属能否锈蚀的关键,围绕金属锈蚀的两个基本要素:氧气和水;设置实验时一定要注意隔绝氧气(可采用植物油油封、蒸馏水去氧、密封隔绝空气、涂上油膜等方式),然后设置一组既有水分又有氧气的实验条件;对于铜而言,生锈的关键要素是水、二氧化碳和氧气;所以在进行实验设置时,考虑这三个要素是关键,如果缺乏任何一个要素,生锈是很困难的,故我们围绕这三个要素进行组合实验条件,进行对比实验组的设置.
解答 解:[猜想]由组成铜绿的四种元素,依据质量守恒的思想,其中C元素来自空气中的二氧化碳气体、H元素来自水,而O元素则可能来自二氧化碳、水或者占空气体积分数21%的氧气,所以铜生锈可能是铜与H2O、O2、CO2作用的结果,
故答案为:H2O、O2、CO2;
(1)A.图A中上层的油层隔离了空气,其中的铜片也就只与水接触,远远不能满足铜锈蚀条件,因此放置时间再长也不会出现锈蚀,故A错误;
B.图B试管中有水且敞口放置,其中铜片与水、二氧化碳、氧气都接触,应该是四只试管中最能满足锈蚀条件的,因此应该最先生锈,故B正确.
C.图C试管内有水和空气,但因管口塞住,不能与外界空气产生气体交换,就会因二氧化碳量不足很难甚至不能出现生锈,故错误;
D.图D试管内因缺少水,不满足铜片锈蚀条件,不会出现生锈现象,故D错误;
故答案为:B;
(2)C试管中除光亮铜片、蒸馏水外还有的另外一种物质为CO2(或O2);
[评介与改进]题图所提供的四只试管,A管因只有水而被去除,B管内为二氧化碳、氧气和水,C管内为氧气和水,D管内为二氧化碳和氧气,综合起来就能发现缺少一组对比:铜片与水和氧(二氧化碳)接触而探究氧气(二氧化碳)对生锈的影响,故设计如图: ,
,
故答案为:CO2(或O2);铜片与水和氧(二氧化碳)接触而探究氧气(二氧化碳)对生锈的影响,设计如图 .
.
点评 本题考查太久铜及其化合物性质的实验,题目难度中等,明确实验目的及实验原理危机的关键,注意掌握常见金属及其化合物性质,试题有利于培养学生的分析、理解能力及化学实验能力.

| A. | 胶体通直流电胶粒向两极移动,非电解质溶液通直流电溶质不移动 | |
| B. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 | |
| C. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带 | |
| D. | 溶液稳定,放置后不会生成沉淀;胶体不稳定,放置会生成沉淀 |
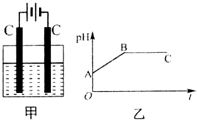 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A. | 是该混合溶液中的SO42-导致了A点溶液的pH值小于B点 | |
| B. | BC段阴极产物和阳极产物的体积之比为2:1 | |
| C. | AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu | |
| D. | 在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |
| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )| A. | 青蒿素和双氢青蒿素互为同分异构体 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素的分子式为C15H22O5 | |
| D. | 青蒿素分子中含有过氧链和酯基、醚键 |

 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.