题目内容
13.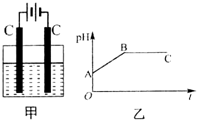 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A. | 是该混合溶液中的SO42-导致了A点溶液的pH值小于B点 | |
| B. | BC段阴极产物和阳极产物的体积之比为2:1 | |
| C. | AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu | |
| D. | 在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
分析 假设溶液中n(CuSO4)=1mol、n(NaCl)=2mol,电解初始,阳极上氯离子放电、阴极上铜离子放电,当转移2mol电子时,阴极上铜离子完全放电生成Cu、阳极上氯离子完全放电生成氯气,溶液中的溶质之间变为硫酸钠,当铜离子、氯离子完全放电后,继续电解,数值上是电解水,溶液的pH不变.
解答 解:假设溶液中n(CuSO4)=1mol、n(NaCl)=2mol,电解初始,阳极上氯离子放电、阴极上铜离子放电,当转移2mol电子时,阴极上铜离子完全放电生成Cu、阳极上氯离子完全放电生成氯气,溶液中的溶质之间变为硫酸钠,当铜离子、氯离子完全放电后,继续电解,数值上是电解水,溶液的pH不变.
A.硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,B点铜离子和氯离子完全放电,溶液中的溶质为强酸强碱盐硫酸钠,所以A点pH小于B点,故A错误;
B.BC段是电解水,阴极上生成氢气、阳极上生成氧气,所以阴极产物和阳极产物的体积之比为2:1,故B正确;
C.AB段是电解CuCl2、BC段是电解H2O,AB段阴极电极反应式为Cu2++2e-→Cu、BC段阴极电极反应式为2H++2e-=H2↑,故C错误;
D.整个电解过程中溶液不呈碱性,所以不会出现氢氧化铜蓝色沉淀,故D错误;
故选B.
点评 本题考查了电解原理,知道乙图各段发生的电极反应式是解本题关键,结合电极反应式来分析解答,题目难度不大.

练习册系列答案
相关题目
4. 如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
 如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )
如图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
1.下列叙述中正确的是( )
| A. | 在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热 | |
| B. | 在101kP时1mol物质燃烧时所放出的热量叫做该物质的燃烧热 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 在相同条件下,1 molH20(l)完全分解吸收的热量与H2、O2化合生成1 molH2O(g)放出的热量数值相等 |
8.下列说法正确的是( )
| A. | 烃是指含有碳、氢元素的化合物 | |
| B. | 烷烃的特征反应是取代反应和氧化反应 | |
| C. | 乙烯聚合后的产物是混合物 | |
| D. | 乙烷与氯气取代后的产物一定是纯净物 |
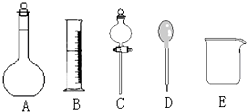 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成240mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成240mL 0.1mol•L-1的盐酸溶液.
 .
.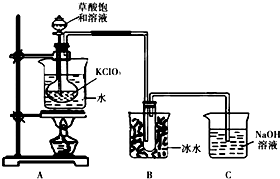 ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)