题目内容
20.下列有关金属腐蚀的叙述正确的是( )| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |
分析 金属的腐蚀有化学腐蚀和电化学腐蚀,所以纯金属或者在干燥环境下金属可能发生化学腐蚀,在形成原电池时铜作负极就比铁作正极腐蚀得快,据此分析.
解答 解:金属的腐蚀有化学腐蚀和电化学腐蚀,所以纯金属可能发生化学腐蚀,在干燥环境下金属也可能发生化学腐蚀,而在形成原电池时铜作负极就比铁作正极腐蚀得快,所以ABC错误,D正确.
故选D.
点评 本题考查学生金属腐蚀的原理以及原电池的工作原理和金属的保护知识,注意基本知识的梳理和归纳很关键,难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
8.下列说法正确的是( )
| A. | 烃是指含有碳、氢元素的化合物 | |
| B. | 烷烃的特征反应是取代反应和氧化反应 | |
| C. | 乙烯聚合后的产物是混合物 | |
| D. | 乙烷与氯气取代后的产物一定是纯净物 |
12.向紫色石蕊中加入过量的Na2O2粉末,震荡,可观察到的现象为( )
| A. | 溶液仍为紫色 | |
| B. | 溶液中有气泡产生,溶液最终变为无色 | |
| C. | 最终溶液褪色,而无其他现象 | |
| D. | 溶液最终变为蓝色 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
18.在20℃时的密闭容器中,加入0.1mol/L的N2O4,经过一段时间后,测定反应体系中各物质的浓度,数据如表.
请根据反应的化学方程式N2O4?2NO2分析:
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) mol/L | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| c(NO2) mol/L | 0.000 | 0.060 | 0.100 | 0.120 | 0.120 | 0.120 |
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).
 .
. (1)有下列五种烃:
(1)有下列五种烃: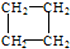 ②
②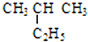 ③乙烷 ④C(CH3)4⑤
③乙烷 ④C(CH3)4⑤ ,其中互为同分异构体的是②④(填序号),②与⑤
,其中互为同分异构体的是②④(填序号),②与⑤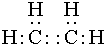 ,E的结构简式为
,E的结构简式为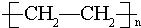 .
.
 .
.