题目内容
10.将金属钠分别投入下列物质的稀溶液中,有气体放出,且有白色沉淀生成的是( )| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
分析 A.钠与硫酸反应生成硫酸钠和氢气;
B.钠与氢氧化钠溶液反应实质是与水反应;
C.钠与氯化铜溶液反应,实质是钠与水反应生成氢氧化钠和氢气,氢氧化钠再与氯化铜反应生成氢氧化铜沉淀;
D.钠与硫酸镁溶液反应,实质是钠与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸镁反应生成氢氧化镁沉淀;
解答 解:A.钠与硫酸反应生成硫酸钠和氢气,没有沉淀生成,故A错误;
B.钠与氢氧化钠溶液反应实质是与水反应生成氢氧化钠和氢气,没有沉淀生成,故B错误;
C.钠与氯化铜溶液反应生成氢氧化铜蓝色沉淀,氢气和氯化钠,故C错误;
D.钠与硫酸镁溶液反应生成氢氧化镁白色沉淀,氢气和硫酸钠,故D正确;
故选:D.
点评 本题考查了钠的性质,明确钠与盐溶液反应实质是钠先与水反应,生成的氢氧化钠再与盐发生复分解反应,据此解答.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
1.下列叙述中正确的是( )
| A. | 在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热 | |
| B. | 在101kP时1mol物质燃烧时所放出的热量叫做该物质的燃烧热 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 在相同条件下,1 molH20(l)完全分解吸收的热量与H2、O2化合生成1 molH2O(g)放出的热量数值相等 |
8.甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I,CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1.
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③在其它条件不变时降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)…Ⅱ.
④该反应的△H<0,△S<0(填“<”、“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离出来C.充入He,使体系总压强增大 D.再充入l mol CO和3mol H2
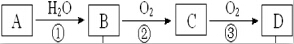
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中.
A.请在上表空格中填入剩余的实验条件数据.
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图2,并标明各条曲线的压强.
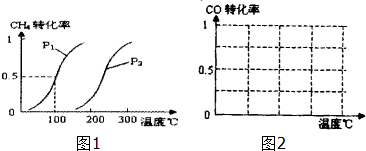
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I,CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1.
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③在其它条件不变时降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)…Ⅱ.
④该反应的△H<0,△S<0(填“<”、“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离出来C.充入He,使体系总压强增大 D.再充入l mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中.
| 实验编号 | T(℃) | n (C)/n | P(MPa) |
| Ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| Ⅱ | 150 | $\frac{1}{3}$ | 5 |
| Ⅲ | 350 | $\frac{1}{3}$ | 5 |
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图2,并标明各条曲线的压强.

 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸,其合成路线如图所示.
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸,其合成路线如图所示.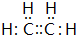
 .
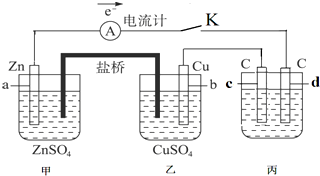
.
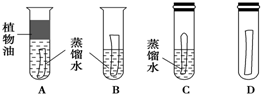
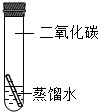 .
.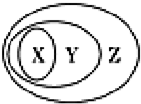 用下图表示的一些物质或概念间的从属关系中不.正确的是( )
用下图表示的一些物质或概念间的从属关系中不.正确的是( )