题目内容
12.在无色透明强酸性溶液中,能大量共存的离子组是( )| A. | K+、Ca2+、HCO3-、SO42- | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Na+、OH-、NO3-、Ba2+ | D. | K+、Mg2+、NO3-、SO42- |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强酸性溶液中存在大量氢离子,
A.碳酸氢根离子与氢离子反应,钙离子与硫酸根离子反应;
B.亚铁离子为有色离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.氢氧根离子与氢离子反应;
D.四种离子之间不反应,都不与氢离子反应,且为无色溶液.
解答 解:溶液无色可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强酸性溶液中存在大量氢离子,
A.Ca2+、SO42-之间发生反应,HCO3-与氢离子反应,在溶液中不能大量共存,故A错误;
B.NO3-、Fe2+、H+之间发生氧化还原反应,Fe2+为有色离子,在溶液中不能大量共存,故B错误;
C.OH-与氢离子反应,在溶液中不能大量共存,故C错误;
D.K+、Mg2+、NO3-、SO42-之间不反应,都不与强酸性溶液中的氢离子反应,且为无色溶液,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
3.同温、同压下等质量的NH3和CH4气体,下列叙述中正确的是( )
①密度之比为17:16 ②体积之比为17:16 ③氢原子个数比为3:4 ④电子数之比为16:17 ⑤原子个数之比为64:85.
①密度之比为17:16 ②体积之比为17:16 ③氢原子个数比为3:4 ④电子数之比为16:17 ⑤原子个数之比为64:85.
| A. | ①③④ | B. | ②④⑤ | C. | ①③ | D. | ①④⑤ |
7.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解.下列表达正确的是( )
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: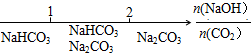 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: |
17.在密闭容器中,mA(g)+bB(g)?pC(g)反应平衡时,测得 c(A)为 0.5mol•L?1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L?1,则下列判断中正确的是( )
| A. | 平衡向正反应方向移动 | B. | 物质C的体积分数增加 | ||
| C. | 化学计量数:m+b<p | D. | 物质B的转化率减小 |
4. 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )| A. | 物质酸性的比较:HB>HA>H2CO3 | |
| B. | 反应结束后所得两溶液中,c(B-)>c(A-) | |
| C. | 上述三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HB溶液>HA溶液 | |
| D. | HA溶液和NaHCO3溶液反应所得溶液中:c(A-)+c(HA)=0.10mol/L |
1.等质量的SO2和SO3相比较,下列判断正确的是( )①含有的氧原子个数之比为5:6;②含有的氧原子个数之比为6:5;③含有的硫原子个数之比为5:4;④含有的硫原子个数相等.
| A. | ①和③ | B. | ①和④ | C. | ②和④ | D. | ②和③ |
1. 50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是温度计.
(2)他们记录的实验数据如表中所示.已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.则中和热△H=-55.2kJ/mol(取小数点后1位);根据实验结果用离子方程式表示上述反应中和热的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-55.2kJ/mol.
(3)下列说法正确的是C(填字母).
A.所有酸、碱稀溶液反应的中和热相等
B.准确测定中和热的实验中,至少需测定温度4次
C.烧杯之间用纸屑填充的目的是为了避免实验测定的△H偏高
D.若改用60mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液进行上述反应,从理论上说,放出的热量相等.
 50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是温度计.
(2)他们记录的实验数据如表中所示.已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.则中和热△H=-55.2kJ/mol(取小数点后1位);根据实验结果用离子方程式表示上述反应中和热的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-55.2kJ/mol.
| 实验 序号 | 起始温度 平均值t1 | 终止温度 t2 |
| 1 | 20℃ | 23.2℃ |
| 2 | 20℃ | 23.4℃ |
A.所有酸、碱稀溶液反应的中和热相等
B.准确测定中和热的实验中,至少需测定温度4次
C.烧杯之间用纸屑填充的目的是为了避免实验测定的△H偏高
D.若改用60mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液进行上述反应,从理论上说,放出的热量相等.
 写出MnO2与浓盐酸反应制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.已知KMnO4与浓盐酸在常温下反应也可制得Cl2,某同学利用该原理,用图所示的装置制备纯净、干燥的氯气,并做氯气与金属反应的实验.每个虚线框表示一个单元装置,其中有错误的是哪几处?②③④(填序号)
写出MnO2与浓盐酸反应制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.已知KMnO4与浓盐酸在常温下反应也可制得Cl2,某同学利用该原理,用图所示的装置制备纯净、干燥的氯气,并做氯气与金属反应的实验.每个虚线框表示一个单元装置,其中有错误的是哪几处?②③④(填序号)