题目内容
16. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于表中:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数.根据表中数据,计算 25.0℃时氨基甲酸铵分解的平衡常数Kp=256(kPa)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
分析 (1)①结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
②容器内气体的浓度之比为2:1,压强分别为8kPa、4kPa,类比K计算kp;
③25.0℃下达到分解平衡.若在恒温下压缩容器体积,平衡逆向移动;
④该反应为气体体积增大的反应,且由表格中数据可知,温度越高,K越大;
(2)⑤结合v=$\frac{△c}{△t}$计算0~6min 氨基甲酸铵水解反应的平均速率;
⑥水解反应为吸热反应,且温度升高,反应速率增大,由图可知,起始浓度、温度不同.
解答 解:(1)①A.2v(NH3)=v(CO2),不能确定正逆反应速率关系,不能判定平衡,故A选;
B.该反应为气体体积不等的反应,则密闭容器中总压强不变,达到平衡状态,故B不选;
C.气体的质量为变量,则密闭容器中混合气体的密度不变,达到平衡状态,故C不选;
D.氨气与二氧化碳的体积比为2:1,密闭容器中氨气的体积分数始终不变,不能判断,故D选;
E.氨气与二氧化碳的体积比为2:1,容器中混合气体的平均相对分子质量始终不变吗,不能判断,故E选;
故答案为:ADE;
②容器内气体的浓度之比为2:1,总压强为12kPa,故NH3和CO2的浓度分别为3.2×10-3 mol/L、1.6×10-3 mol/L,压强分别为8kPa、4kPa,Kp=82×4=256(kPa)3,
故答案为:256(kPa)3;
③25.0℃下达到分解平衡.若在恒温下压缩容器体积,平衡逆向移动,所以固体质量会增加,故答案为:增加;
④由表格中数据可知,温度越高,K越大,氨基甲酸铵分解反应的焓变△H>0,为气体体积增大的反应,则熵变△S>0,故答案为:>;>;
(2)⑤0~6min 氨基甲酸铵水解反应的平均速率v=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
⑤由图可知,起始浓度、温度不同,因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,则该水解反应速率随温度升高而增大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡常数及速率的计算、平衡移动、平衡判定为解答的关键,侧重分析与计算能力的考查,注意表格数据的应用,题目难度不大.

 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O℃在CH3CH2OH中),写出能表示18O位置的化学方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示):CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇(或CaCl2•6C2H5OH);再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在77.1℃左右.
| A. | 瓜皮果壳--可回收垃圾 | B. | 塑料--危险废物 | ||
| C. | 厨余垃圾--有机垃圾 | D. | 易拉罐--不可回收垃圾 |
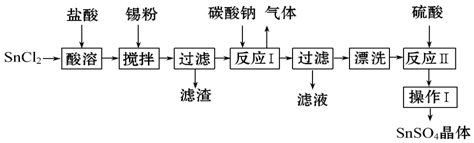
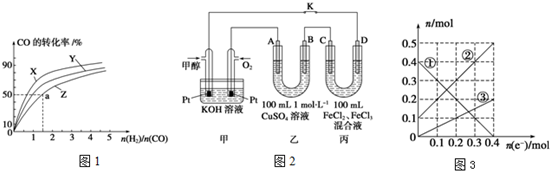
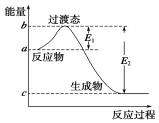 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.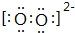 .
.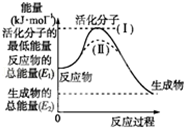 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.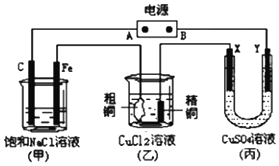 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题: