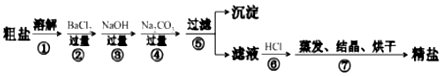
题目内容
12.SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备路线如图: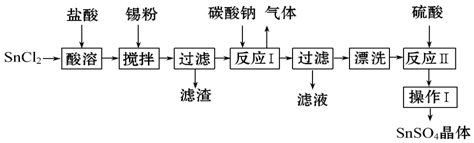
已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是第5周期ⅣA族.
(2)操作Ⅰ是蒸发浓缩、冷却结晶、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+的水解.
(4)加入锡粉的作用有两个:①调节溶液pH,②防止Sn2+被氧化.
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是Sn2++CO32-═SnO↓+CO2↑.
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是Sn2++H2O2+2H+═Sn4++2H2O.
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2,反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100mol•L-1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是86.6%.(保留一位小数)
分析 SnCl2粉末加浓盐酸进行溶解得到酸性溶液,此时溶液中含有Sn2+、Sn4+,向其中加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH值,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+,过滤得SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,根据原子序数减各周期容纳元素种数确定所在的周期;
(2)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(7)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,据此计算.
解答 解:SnCl2粉末加浓盐酸进行溶解得到酸性溶液,此时溶液中含有Sn2+、Sn4+,向其中加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH值,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+,过滤得SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,其原子核外有5个电子层,所以位于第5周期第IVA族,
故答案为:第5周期ⅣA族;
(2)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,所以操作I是蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩;冷却结晶;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化,
故答案为:防止Sn2+被氧化;
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O.
(7)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7
119g $\frac{1}{3}$mol
1.360g×x 0.100mol/L×0.033L
故119g:$\frac{1}{3}$mol=(1.360g×x):(0.100mol/L×0.033L)
x=$\frac{119g×(0.100mol/L×0.033L)}{\frac{1}{3}mol×1.360g}$=86.6%,
故答案为:86.6%.
点评 本题SnSO4制备为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、滴定应用及利用关系式进行的计算等,对学生的基础知识及逻辑推理有较高的要求,难点是确定Sn和K2Cr2O7的关系式,题目难度中等.

(1)配制250ml0.1mol/L的盐酸溶液
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
A.用30ml水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
E.将容量瓶盖紧,振荡,摇匀
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(3)操作A中,将洗涤液均注入容量瓶,其目的是防止烧杯中的残留液没有移入容量瓶使溶液浓度减少.溶液注入容量瓶前需恢复到室温,这是因为盐酸溶解放热使溶液体积膨胀,不冷却会使溶液浓度增大..
(4)若实验过程中出现下列情况如何处理?
加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面重新配制.
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为C+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量等于(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是A
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为2O3(g)═3O2(g)△H=-285kJ/mol.
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于表中:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数.根据表中数据,计算 25.0℃时氨基甲酸铵分解的平衡常数Kp=256(kPa)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.