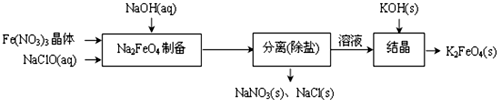
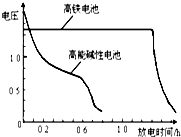
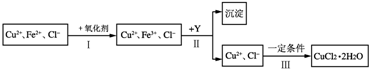
题目内容
次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成的盐只有NaH2PO2一种,若浓度均为0.1mol/L的次磷酸(H3PO2)与盐酸相比前者导电能力弱.又知H3PO2具有较强还原性,可将溶液中的Ag+还原为银.下列说法错误的是( )
| A、H3PO2中,P元素的化合价为+1价 |
| B、在溶液中Ag+氧化H3PO2为H3PO4时,氧化剂与还原剂的物质的量之比为4:1 |
| C、次磷酸在水中的电离方程式为H3PO2?H++H2PO2- |
| D、NaH2PO2属于酸式盐 |
考点:氧化还原反应
专题:
分析:A.根据化合物中化合价的代数和为零计算;
B.根据得失电子守恒判断;
C.次磷酸属于一元弱酸;
D.次磷酸属于一元弱酸,一元酸没有酸式盐.
B.根据得失电子守恒判断;
C.次磷酸属于一元弱酸;
D.次磷酸属于一元弱酸,一元酸没有酸式盐.
解答:
解:A.H3PO2中O为-2价,H为+1价,由化合物中化合价的代数和为零可知,P元素的化合价为+1价,故A正确;
B.该反应中Ag+为氧化剂,H3PO2为还原剂,反应产物H3PO4中P的化合价为+5,设Ag+为x,H3PO2为y,根据得失电子守恒可得,x×(1-0)=y×(5-1),解得x:y=4:1,即氧化剂与还原剂的物质的量之比为4:1,故B正确;
C.磷酸(H3PO2)与足量的氢氧化钠溶液反应生成的盐只有NaH2PO2一种,说明次磷酸属于一元酸,若浓度均为0.1mol/L的次磷酸(H3PO2)与盐酸相比前者导电能力弱,说明次磷酸部分电离为弱酸,则次磷酸在水中的电离方程式为H3PO2?H++H2PO2-,故C正确;
D.由C项分析可知次磷酸属于一元弱酸,一元酸没有酸式盐,故D错误.
故选D.
B.该反应中Ag+为氧化剂,H3PO2为还原剂,反应产物H3PO4中P的化合价为+5,设Ag+为x,H3PO2为y,根据得失电子守恒可得,x×(1-0)=y×(5-1),解得x:y=4:1,即氧化剂与还原剂的物质的量之比为4:1,故B正确;
C.磷酸(H3PO2)与足量的氢氧化钠溶液反应生成的盐只有NaH2PO2一种,说明次磷酸属于一元酸,若浓度均为0.1mol/L的次磷酸(H3PO2)与盐酸相比前者导电能力弱,说明次磷酸部分电离为弱酸,则次磷酸在水中的电离方程式为H3PO2?H++H2PO2-,故C正确;
D.由C项分析可知次磷酸属于一元弱酸,一元酸没有酸式盐,故D错误.
故选D.
点评:本题考查了氧化还原反应的知识等,涉及化合价的判断、电子守恒的应用、弱电解质的电离等知识,侧重于学生的分析能力的考查,难度不大.

练习册系列答案
相关题目
下列有关物质用途的说法错误的是( )
| A、过氧化钠可用作潜水艇供氧剂 |
| B、氧化铝是一种耐火材料,可制耐高温实验材料 |
| C、氧化铁可用作红色油漆和涂料 |
| D、氢氧化铝、苏打等可用于治疗胃酸过多 |
某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A、KOH |
| B、KHSO4 |
| C、HCl |
| D、K2CO3 |
下列有关说法正确的是( )
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
下列溶液中的Cl-浓度与50mL 1.0mol?L-1 FeCl3溶液中的Cl-浓度相等的是( )
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
设NA为阿伏加德罗常数,如果ag某气体含分子数为P,则bg该气体在标准状况下的体积V(L)是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4L水的分子数为NA |
| B、常温下将23gNa投入到0.5L1.0mol?L-1的盐酸中反应共转移的电子数为0.5NA |
| C、0.5mol/LKCl溶液中含有0.5NA个K+ |
| D、12.0g熔融的NaHSO4中含有0.1NA个阳离子 |