题目内容
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如下图所示:
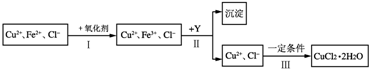
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的 (填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为 .
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的 (填字母);A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是 .
(3)步骤Ⅲ应控制的实验条件是 .

请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是
(3)步骤Ⅲ应控制的实验条件是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:CuCl2溶液中含有少量杂质FeCl2,加入氧化剂应不能引入杂质离子,为过氧化氢氧化亚铜离子为铁离子,加入氧化铜或碳酸铜或碱式碳酸铜调节溶液PH使铁离子全部沉淀,过滤得到氯化铜溶液,蒸发浓缩,冷却结晶过滤洗涤得到纯净的CuCl2?2H2O晶体;
(1)氧化亚铁离子的氧化剂不能引入新的杂质,
(2)①过程是提纯氯化铜,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,但不能引入新的杂质分析判断;
②胶体遇到电解质溶液发生聚沉,继续滴加稀硫酸沉淀溶解;
(3)氯化铜溶液得到氯化铜晶体的方法应在氯化氢气流中低温加热蒸发,防止氯化铜水解生成氢氧化铜.
(1)氧化亚铁离子的氧化剂不能引入新的杂质,
(2)①过程是提纯氯化铜,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,但不能引入新的杂质分析判断;
②胶体遇到电解质溶液发生聚沉,继续滴加稀硫酸沉淀溶解;
(3)氯化铜溶液得到氯化铜晶体的方法应在氯化氢气流中低温加热蒸发,防止氯化铜水解生成氢氧化铜.
解答:
解:CuCl2溶液中含有少量杂质FeCl2,加入氧化剂应不能引入杂质离子,为过氧化氢氧化亚铜离子为铁离子,加入氧化铜或碳酸铜或碱式碳酸铜调节溶液PH使铁离子全部沉淀,过滤得到氯化铜溶液,蒸发浓缩,冷却结晶过滤洗涤得到纯净的CuCl2?2H2O晶体;
(1)氧化亚铁离子的氧化剂不能引入新的杂质,
A.K2Cr2O7,能氧化亚铁离子但引入钾离子、铬离子杂质,故A错误;
B.NaClO氧化亚铜离子,但引入钠离子,故B错误;
C.H2O2氧化亚铁离子,过氧化氢被还以为水,不引入新的杂质,故C正确;
过氧化氢氧化亚铁离子反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:C;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)①过程是提纯氯化铜,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,但不能引入新的杂质分析,氢氧化钠会引入杂质离子钠离子,铜不能调节溶液PH,Cu2(OH)2CO3可以和盐溶液水解的酸性溶液反应调节溶液PH不引入新的杂质,故答案为:C;
②胶体遇到电解质溶液发生聚沉,继续滴加稀硫酸沉淀溶解,将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液,
故答案为:先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液;
(3)氯化铜溶液得到氯化铜晶体的方法:应在氯化氢气流中低温加热蒸发,防止氯化铜水解生成氢氧化铜,
故答案为:将溶液在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解.
(1)氧化亚铁离子的氧化剂不能引入新的杂质,
A.K2Cr2O7,能氧化亚铁离子但引入钾离子、铬离子杂质,故A错误;
B.NaClO氧化亚铜离子,但引入钠离子,故B错误;
C.H2O2氧化亚铁离子,过氧化氢被还以为水,不引入新的杂质,故C正确;
过氧化氢氧化亚铁离子反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:C;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)①过程是提纯氯化铜,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,但不能引入新的杂质分析,氢氧化钠会引入杂质离子钠离子,铜不能调节溶液PH,Cu2(OH)2CO3可以和盐溶液水解的酸性溶液反应调节溶液PH不引入新的杂质,故答案为:C;
②胶体遇到电解质溶液发生聚沉,继续滴加稀硫酸沉淀溶解,将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液,
故答案为:先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液;
(3)氯化铜溶液得到氯化铜晶体的方法:应在氯化氢气流中低温加热蒸发,防止氯化铜水解生成氢氧化铜,
故答案为:将溶液在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解.
点评:本题考查了物质分离和提纯的实验方法和流程分析判断,主要是物质性质理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成的盐只有NaH2PO2一种,若浓度均为0.1mol/L的次磷酸(H3PO2)与盐酸相比前者导电能力弱.又知H3PO2具有较强还原性,可将溶液中的Ag+还原为银.下列说法错误的是( )
| A、H3PO2中,P元素的化合价为+1价 |
| B、在溶液中Ag+氧化H3PO2为H3PO4时,氧化剂与还原剂的物质的量之比为4:1 |
| C、次磷酸在水中的电离方程式为H3PO2?H++H2PO2- |
| D、NaH2PO2属于酸式盐 |
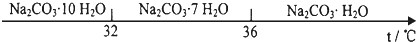
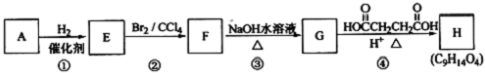
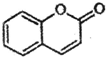 ) 是一种存在于某些植物的果、花等中的天然香料.又知:
) 是一种存在于某些植物的果、花等中的天然香料.又知: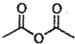 ;
;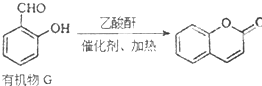
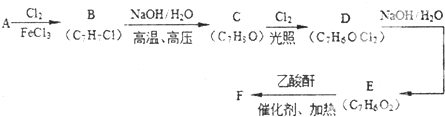
 (是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
(是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下: W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
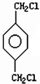 →A:
→A: