题目内容
20. 已知乙酸和乙醇在浓硫酸催化下会发生下列反应:
已知乙酸和乙醇在浓硫酸催化下会发生下列反应:CH3CH2OH+CH3COOH$?_{120℃}^{浓硫酸}$ CH3COOCH2CH3+H2O
CH3CH2OH+CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
沸点:乙醇78.5℃、乙酸117.9℃、乙酸乙酯77.1℃
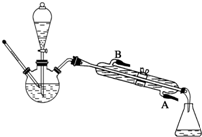
某同学为了在实验室制备乙酸乙酯,设计了如图所示的装置(部分类持仪器省略).实验步骤:
①在干燥的100mL三颈烧瓶中加入8mL 95%的乙醇,在冷水冷却下,边摇边慢慢加入8mL浓硫酸,加入碎瓷片;在滴液漏斗中加入8mL 95%的乙醇和8mL乙酸,摇匀.按图组装仪器.滴液漏斗的末端和温度计的水银球必须浸到液面以下距瓶底0.5cm~1cm处.
②用电热套加热烧瓶,当温度计读数上升到110℃时,从滴液漏斗中滴加乙醇和乙酸混合液(速度为每分钟30滴为宜),并维持适宜的反应温度.滴加完毕,继续加热数分钟,直到反应液温度升到130℃,不再有馏出液为止.
③洗涤粗产物.
请回答下列问题:
(1)碎瓷片的作用是防止液体暴沸.冷凝管的作用是冷凝收集乙酸乙酯,水要从A(填“A”或“B”)口进入.馏出液的成分有乙酸乙酯、乙酸、乙醇.
(2)整个实验过程要严格控制温度在120℃左右,否则会发生副反应,使制得的乙酸乙酯不纯(或含有乙醚).
(3)洗涤粗产物的方法是:向粗产物中慢慢加入饱和碳酸钠溶液,然后用分液法分离.下列有关分液操作的叙述正确的是d(填字母序号).
a.应选用球形分液漏斗进行分液,使用前要检查是否漏水
b.将混合液倒入分液漏斗,塞紧玻璃塞,上下振荡
c.混合液摇匀后,立即将分液漏斗放在铁圈上静置,分层
d.打开分液漏斗的玻璃塞,再打开旋塞,使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出
(4)为了得到更纯的产物,需向(3)中得到的酯中加入无水硫酸镁进行干燥,然后通过蒸馏法分离.
下列区分乙酸乙酯精品和粗品的方法,不合理的是ad.
a.用溴水检验 b.用金属钠检验
c.测定沸点 d.用新制Cu(OH)2悬浊液检验
(5)本实验如何创造条件使酯化反应尽量向生成物方向进行?(至少提出两点)
①加入过量的乙醇
②将乙酸乙酯从反应液中不断蒸出,使平衡向乙酸乙酯产生的方向移动.
分析 (1)沸点低的液体加热要加碎瓷片,防止暴沸;采用冷凝管的作用是将挥发出的蒸气冷凝使其流到锥形瓶中,冷凝管的水流方向应为逆流效果好,所以应从A进B出,制备乙酸乙酯,馏出液的成分有乙酸乙酯、乙酸、乙醇;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,反应温度为120℃,若控制不好反应温度,会发生副反应,使制得的乙酸乙酯不纯(或含有乙醚);
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;打开分液漏斗上口活塞使漏斗内外空气相通,先流出下层液体,后倒出上层液体;
(4)酯中含有水,可用无水的硫酸镁进行干燥,酯中可溶性的有机物,可利用沸点不同进行蒸馏分离,乙酸乙酯精品和粗品不同为粗品中含有乙酸、乙醇等杂质;
(5)制备乙酸乙酯的反应为可逆反应,根据平衡移动原理解答,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,使酯化反应尽量向生成物方向进行,可增大反应物的浓度,或减少生成物的浓度.
解答 解:(1)液体乙酸乙醇沸点低,加入沸石(碎瓷片),可以通过沸石(碎瓷片)孔隙凝聚蒸汽,使成为气泡浮出,防止暴沸,制备乙酸乙酯,采用冷凝管的作用是将挥发出的生成物乙酸乙酯蒸气冷凝使其流到锥形瓶中,冷凝管的水流方向应为逆流效果好,从A进B出,能克服水的重力充满冷凝管,使冷凝效果更好,制备乙酸乙酯,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,CH3COOH+C2H5OH CH3COOC2H5+H2O,该反应为可逆反应,所以馏出液的成分有乙酸乙酯、乙酸、乙醇,
CH3COOC2H5+H2O,该反应为可逆反应,所以馏出液的成分有乙酸乙酯、乙酸、乙醇,
故答案为:防止液体暴沸; 冷凝收集乙酸乙酯;A;乙酸乙酯、乙酸、乙醇;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,CH3CH2OH+CH3COOH$?_{120℃}^{浓硫酸}$ CH3COOCH2CH3+H2O,反应需严格控制温度在为120℃,若控制不好反应温度,会发生副反应CH3CH2OH+CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,使制得的乙酸乙酯不纯(或含有乙醚),
故答案为:120;发生副反应,使制得的乙酸乙酯不纯(或含有乙醚);
(3)乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠反应,用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯不溶于水溶液,所以分离的方法为分液,打开分液漏斗上口活塞使漏斗内外空气相通,保证液体顺利流出,乙酸乙酯密度小于水,所以先使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出,d符合,
故答案为:饱和碳酸钠;d;
(4)提纯产物,(3)中得到的酯中含有水,用无水的硫酸镁进行干燥,酯中可溶性的有机物,可利用乙酸乙酯77.1℃进行蒸馏分离,乙酸乙酯精品和粗品不同为粗品中含有乙酸、乙醇等杂质,都能与金属钠反应,可用金属钠检验,乙酸乙酯精品为纯净物,有固定溶沸点,可测其沸点确定,新制Cu(OH)2悬浊液与以及溴水与乙酸、乙醇等杂质不反应,不能用于检验,
故答案为:蒸馏;ad;
(5)制备乙酸乙酯的反应为可逆反应,增大某一反应的浓度,平衡向正反应移动,所以加入过量的乙醇,可使酯化反应向生成物方向进行,分离出生成物,生成物的浓度减小,平衡向正反应方向移动,
故答案为:加入过量的乙醇;将乙酸乙酯从反应液中不断蒸出,使平衡向乙酸乙酯产生的方向移动.
点评 本题考查乙酸乙酯的制备、物质的分离提纯等,把握有机物的性质、制备实验中仪器的作用、混合物分离提纯等为解答的关键,侧重分析、实验能力的综合考查,注意基础知识、工艺流程的理解掌握、知识的积累和实验基本操作的理解应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
己二酸
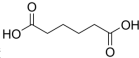 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图: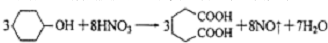
可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)仪器b的名称为球形冷凝管(或冷凝管).
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸,产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2、NO+NO2+Na2CO3═2NaNO2+CO2.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶 法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
| A. | 酸和碱反应生成1mol水时所放出的热 | |
| B. | 1mol酸和1mol碱反应生成盐和水时所放出的热 | |
| C. | 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热 |
 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.
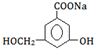
 ,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).
,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性). 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.
 .
. .
. .
.