题目内容
操作1:将1L 1.00mol?L-1的Na2CO3溶液逐滴加入到1L 1.25mol?L-1的盐酸中;
操作2:将1L 1.25mol?L-1的盐酸逐滴加入1L 1.00mol?L-1 的Na2CO3溶液中,
两次操作产生的气体体积之比(同温同压下)是( )
操作2:将1L 1.25mol?L-1的盐酸逐滴加入1L 1.00mol?L-1 的Na2CO3溶液中,
两次操作产生的气体体积之比(同温同压下)是( )
| A、5:2 | B、2:5 |
| C、1:1 | D、2:1 |
考点:离子方程式的有关计算
专题:
分析:向盐酸溶液中滴加Na2CO3溶液,盐酸足量,发生反应Na2CO3+2HCl=2NaCl+CO2↑+H2O;但向Na2CO3溶液中滴加稀盐酸,盐酸不足,首先发生Na2CO3+HCl=NaHCO3+NaCl,然后发生NaHCO3+HCl=NaCl+CO2↑+H2O,据此根据方程式进行过量计算.
解答:
解:1L 1.00mol/L 的Na2CO3溶液中n(Na2CO3)=1L×1mol/L=1mol,
1L 1.25mol/L的盐酸中n(HCl)=1L×1.25mol/L=1.25mol,
把Na2CO3溶液逐滴加到盐酸中,开始时盐酸过量,发生反应Na2CO3+2HCl=2NaCl+H2O+CO2↑,故:
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
1mol 2mol
故HCl不足,由方程式可知,生成二氧化碳物质的量为1.25mol×
=0.625mol,
向Na2CO3溶液逐滴滴入盐酸,首先发生:Na2CO3+HCl=NaHCO3+NaCl,则:
Na2CO3+HCl=NaHCO3+NaCl
1mol 1mol
1molNa2CO3消耗1molHCl,剩余0.25molHCl,故生成1molNaHCO3
然后发生:NaHCO3+HCl=NaCl+CO2↑+H2O;
0.25mol 0.25mol
故NaHCO3有剩余,生成二氧化碳0.25mol,
故两次操作产生的气体体积之比是0.625mol:0.25mol=5:2,
故选A.
1L 1.25mol/L的盐酸中n(HCl)=1L×1.25mol/L=1.25mol,
把Na2CO3溶液逐滴加到盐酸中,开始时盐酸过量,发生反应Na2CO3+2HCl=2NaCl+H2O+CO2↑,故:
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
1mol 2mol
故HCl不足,由方程式可知,生成二氧化碳物质的量为1.25mol×
| 1 |
| 2 |
向Na2CO3溶液逐滴滴入盐酸,首先发生:Na2CO3+HCl=NaHCO3+NaCl,则:
Na2CO3+HCl=NaHCO3+NaCl
1mol 1mol
1molNa2CO3消耗1molHCl,剩余0.25molHCl,故生成1molNaHCO3
然后发生:NaHCO3+HCl=NaCl+CO2↑+H2O;
0.25mol 0.25mol
故NaHCO3有剩余,生成二氧化碳0.25mol,
故两次操作产生的气体体积之比是0.625mol:0.25mol=5:2,
故选A.
点评:本题考查混合物的有关计算、Na2CO3与盐酸的反应,难度中等,清楚滴加顺序不同所发生的反应是关键.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验:
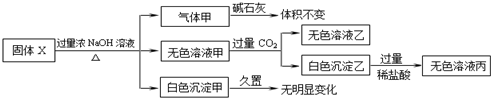
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |
由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向混合物中加入足量盐酸,有气体逸出,将放出的气体通过过量的NaOH溶液后,气体体积有所减小,或将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前有所增加,下列推断正确的是( )
| A、混合物中一定含有Na2O、Na2O2、和NaHCO3 |
| B、混合物中一定不含Na2CO3和NaCl |
| C、混合物中可能含有Na2O和NaCl |
| D、混合物中一定不含Na2O2和NaCl |
用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1一4.4).下列判断正确的是( )
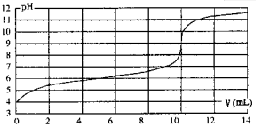

| A、HA的浓度为1×10-4mol?L-1 |
| B、实验时可选甲基橙作指示剂 |
| C、V=10mL,酸碱恰好中和 |
| D、pH=7时,溶液中c(Na+)>c(A-) |
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题: