题目内容
(1)A、B、C、D、E分别为(NH4)2SO4、NH4Cl、NaCl、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合.
①A和B混合产生白色沉淀,加热后无明显变化;
②B和C混合产生白色沉淀,加热后产生使湿润红色石蕊试纸变蓝的气体;
③B和E混合无明显变化,加热后产生使湿润红色石蕊试纸变蓝的气体.
a.根据以上现象,判断溶液A、B、C、D、E中的溶质各是什么物质(填化学式)
A B C D
b.写出B与E混合反应的化学方程式
(2)配平下列化学方程式
① Na2FeO2+ NaNO2+ H2O-- Na2Fe2O4+ NH3↑+ NaOH
② Fe(OH)3+ ClO-+ OH--- FeO42-+ Cl-+ H2O
(3)已知有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有 种元素, 种核素.
①A和B混合产生白色沉淀,加热后无明显变化;
②B和C混合产生白色沉淀,加热后产生使湿润红色石蕊试纸变蓝的气体;
③B和E混合无明显变化,加热后产生使湿润红色石蕊试纸变蓝的气体.
a.根据以上现象,判断溶液A、B、C、D、E中的溶质各是什么物质(填化学式)
A
b.写出B与E混合反应的化学方程式
(2)配平下列化学方程式
①
②
(3)已知有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有
考点:几组未知物的检验,氧化还原反应
专题:物质检验鉴别题
分析:(1)能与其它两种物质反应生成白色沉淀的只有Ba(OH)2,则B为Ba(OH)2,
①A与B混合,产生白色沉淀,加热时无刺激性气体生成,说明A为Na2SO4,
②B与C混合也产生白色沉淀,但加热时有刺激性气体生成,且该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则C为(NH4)2SO4,
③B与E混合,无明显现象,但加热后产生能使湿润的红色石蕊试纸变蓝的气体,E应为NH4Cl;所以D为NaCl.
(2)根据电子守恒和原子守恒知识来配平方程式;
(3)根据质子数决定元素的种类,质子数和中子数决定核素的种类.
①A与B混合,产生白色沉淀,加热时无刺激性气体生成,说明A为Na2SO4,
②B与C混合也产生白色沉淀,但加热时有刺激性气体生成,且该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则C为(NH4)2SO4,
③B与E混合,无明显现象,但加热后产生能使湿润的红色石蕊试纸变蓝的气体,E应为NH4Cl;所以D为NaCl.
(2)根据电子守恒和原子守恒知识来配平方程式;
(3)根据质子数决定元素的种类,质子数和中子数决定核素的种类.
解答:
解:(1)a.能与其它两种物质反应生成白色沉淀的只有Ba(OH)2,则B为Ba(OH)2,
A与B混合,产生白色沉淀,加热时无刺激性气体生成,说明A为Na2SO4,
B与C混合也产生白色沉淀,但加热时有刺激性气体生成,且该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则C为(NH4)2SO4,
B与D混合,无明显现象,但加热后产生能使湿润的红色石蕊试纸变蓝的气体,E应为NH4Cl,所以D为NaCl,
故答案为:Na2SO4;Ba(OH)2;(NH4)2SO4;NaCl;NH4Cl;
b.B为Ba(OH)2,E为NH4Cl,二者反应的化学方程式为Ba(OH)2+2NH4Cl=BaCl2+2NH3↑+2H2O,离子方程式为:OH-+NH4+
NH3↑+H2O;
故答案为:OH-+NH4+
NH3↑+H2O.
(2)①反应中,Fe元素的化合价升高了一价,但元素的化合价降低了6价,所以Na2FeO2的系数是6,NaNO2的系数是1,根据原子守恒,Na2Fe2O4的系数是3,水前面系数是5,氨气的前面系数为1,故答案为:6;1;5;3;1;7;
②Fe元素从+3价升高到+6价,转移3个电子,ClO-→Cl-,Cl元素从+1价降低到-1价,得到2个电子,根据得失电子守恒,Fe(OH)3的计量数为2,ClO-的计量数为3,再根据原子守恒配平方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2;3;4;2;3;5;
(3)在1H216O、D2S、3H218O、S17O2、2H2S、S16O2中有氧元素、氢元素和硫元素三种,这三种元素中具有一定数目的质子数和一定数目的中子数均属于核素,有1H、2H、3H、16O、17O、18O、S七种核素,故答案为:三;七.
A与B混合,产生白色沉淀,加热时无刺激性气体生成,说明A为Na2SO4,
B与C混合也产生白色沉淀,但加热时有刺激性气体生成,且该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则C为(NH4)2SO4,
B与D混合,无明显现象,但加热后产生能使湿润的红色石蕊试纸变蓝的气体,E应为NH4Cl,所以D为NaCl,
故答案为:Na2SO4;Ba(OH)2;(NH4)2SO4;NaCl;NH4Cl;
b.B为Ba(OH)2,E为NH4Cl,二者反应的化学方程式为Ba(OH)2+2NH4Cl=BaCl2+2NH3↑+2H2O,离子方程式为:OH-+NH4+
| ||
故答案为:OH-+NH4+
| ||
(2)①反应中,Fe元素的化合价升高了一价,但元素的化合价降低了6价,所以Na2FeO2的系数是6,NaNO2的系数是1,根据原子守恒,Na2Fe2O4的系数是3,水前面系数是5,氨气的前面系数为1,故答案为:6;1;5;3;1;7;
②Fe元素从+3价升高到+6价,转移3个电子,ClO-→Cl-,Cl元素从+1价降低到-1价,得到2个电子,根据得失电子守恒,Fe(OH)3的计量数为2,ClO-的计量数为3,再根据原子守恒配平方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2;3;4;2;3;5;
(3)在1H216O、D2S、3H218O、S17O2、2H2S、S16O2中有氧元素、氢元素和硫元素三种,这三种元素中具有一定数目的质子数和一定数目的中子数均属于核素,有1H、2H、3H、16O、17O、18O、S七种核素,故答案为:三;七.
点评:本题考查元素化合物知识,侧重于考查学生综合运用化学知识的能力,注意根据反应的现象进行判断,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列判断错误的是( )
| A、NA个H+的质量为1 g |
| B、2 L 0.5mol/L Na2SO4溶液中含2NA个Na+ |
| C、32 g O2中含有2NA个O原子 |
| D、相同质量的CO和N2,其体积比一定为1:1 |
下列描述正确的是( )
| A、摩尔是国际单位制中的一个基本物理量 |
| B、萃取操作时,可以选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、当光束分别通过氢氧化铁胶体、氯化铁溶液时,都可以从侧面看见光亮的通路 |
| D、根据分散质粒子的直径大小,分散系可分为溶液、胶体和浊液 |
固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验:
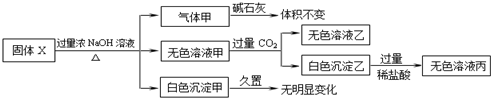
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |
向某盐溶液中加入BaCl2溶液时,有不溶于稀HNO3的白色沉淀生成,而向该溶液中加入NaOH 溶液时有蓝色沉淀生成,则该盐的化学式为( )
| A、CuCO3 |
| B、Na2SO4 |
| C、CuSO4 |
| D、Cu(NO3)2 |
用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1一4.4).下列判断正确的是( )


| A、HA的浓度为1×10-4mol?L-1 |
| B、实验时可选甲基橙作指示剂 |
| C、V=10mL,酸碱恰好中和 |
| D、pH=7时,溶液中c(Na+)>c(A-) |
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示),请根据其性质回答下列问题: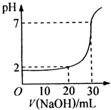 如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )
如图为用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图示.依据图示,推出盐酸和NaOH的物质的量浓度是( )