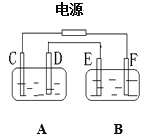
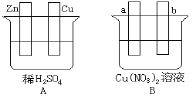
题目内容
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
【答案】A
【解析】
①Zn(s)+![]() O2(g)=ZnO(s) △H1=-351.1 kJ/mol
O2(g)=ZnO(s) △H1=-351.1 kJ/mol
②Hg(l)+ ![]() O2(g)=HgO(s) △H2=-90.7 kJ/mol
O2(g)=HgO(s) △H2=-90.7 kJ/mol
根据盖斯定律,①-②得③:Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=△H1-△H2=-351.1kJ/mol-(-90.7kJ/mol)=-260.4kJ/mol;A项正确;
故选A。

【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.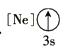 B.
B.![]() C.
C.![]() D.
D.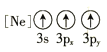
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与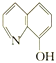 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。