题目内容
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.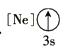 B.
B.![]() C.
C.![]() D.
D.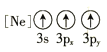
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
【答案】3d104s24p3 D 正四面体 O N sp2 AlF3、GaF3为离子晶体,AlCl3为分子晶体,晶格能:AlF3>GaF3, 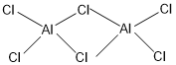 4
4
【解析】
(1) As为33号元素,原子核外电子数为33,其核外电子排布式为1s22s22p63s23p63d104s24p3;能量越高越不稳定,越易失电子,所以激发态的微粒易失电子,原子轨道中处于半满状态时较稳定;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;元素的非金属性越强,电负性越大,而金属性越强,通常第一电离能最小;根据分子结构中N原子成键数和孤对电子数判断杂化方式;
=4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;元素的非金属性越强,电负性越大,而金属性越强,通常第一电离能最小;根据分子结构中N原子成键数和孤对电子数判断杂化方式;
(3)通常离子晶体的熔点大于分子晶体,离子晶体的晶格能大熔点高;
②二聚体Al2Cl6中Al原子有空轨道,Cl可以提供孤电子对形成配位键;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目。
(1) 基态As原子核外有33个电子,电子排布式为1s22s22p63s23p63d104s24p3,即[Ar] 3d104s24p3;A为失去两个电子后的状态, B为失去一个电子后的状态,C为失去三个电子后的状态, D为有一个电子的跃迁的激发态,A电离最外层一个电子所需能量实际就是第三电离能,B电离最外层一个电子所需能量实际就是第二电离能,C电离最外层一个电子所需能量实际就是第四电离能,D电离最外层一个电子所需能量为处于激发态的1个电子,所以需要能量最大的是C,最小的是D,故答案为D;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,sp3杂化,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形; 8—羟基喹啉合铝中所含元素分别是C、H、N、O和Al元素,其中氧元素的非金属性最强,则电负性最大的是O;Al是金属元素,易失电子,第一电离能较小,而非金属元素第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O,则N元素的第一电离能最大;分子中N原子的成键数是2和孤对电子数是1,杂化轨道数目为3,N原子采取sp2杂化;
=4且不含孤电子对,sp3杂化,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形; 8—羟基喹啉合铝中所含元素分别是C、H、N、O和Al元素,其中氧元素的非金属性最强,则电负性最大的是O;Al是金属元素,易失电子,第一电离能较小,而非金属元素第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O,则N元素的第一电离能最大;分子中N原子的成键数是2和孤对电子数是1,杂化轨道数目为3,N原子采取sp2杂化;
(3)①表格中卤化物的熔点产生差异的原因是AlF3和GaF3是离子晶体,且晶格能AlF3>GaF3,则AlF3的熔点比GaF3高,而AlCl3是分子晶体,其熔点明显比AlF3和GaF3的熔点低;
②熔融时AlCl3生成可挥发的二聚体Al2Cl6,该二聚体由Al提供空轨道,Cl原子提供电子对形成配位键,其结构式为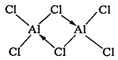 ;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4。
;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案