题目内容
17.现有下列8种物质,请用序号增空:①NH3•H2O ②NH4Cl ③NaHCO3 ④Na2CO3⑤CH3COOH ⑥CH3COONa ⑦NH4HCO3 ⑧NH4HSO4
(1)上述物质中属于弱电解质的是①⑤.
(2)上述物质溶于水时,水的电离程度会减小的是①⑤⑧.
(3)同温下,等物质的量浓度的①、②、⑦、⑧四种物质的水溶液中,NH4+的浓度由大到小的顺序是⑧②⑦①.
(4)NaHCO3溶液中各离子浓度由大到小顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
(5)25℃时,将PH=4的H2SO4溶液与PH=9的 NaOH溶液混合后,当溶液中C(Na+)=2C(SO42-)时,加入硫酸和氢氧化钠体积比为1:10.
分析 (1)水溶液中部分电离的电解质为弱电解质;
(2)酸碱抑制水的电离,水解的盐促进水的电离;
(3)①NH3•H2O 是弱电解质存在电离平衡,铵根离子浓度最小,
②NH4Cl 铵根离子水解溶液显酸性,
⑦NH4HCO3 溶液中碳酸氢根离子水解促进铵根离子水解,铵根离子浓度减小,
⑧NH4HSO4,溶液中氢离子抑制铵根离子水解,铵根离子浓度增大;
(4)碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(HCO3-),据此判断碳酸氢钠溶液中的离子浓度大小;
(5)溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+2c(SO42-),当溶液中c(Na+)=2c(SO42-)时,c(H+)=c(OH-)溶液显中性,氢离子物质的量和氢氧根离子物质的量相同.
解答 解:(1)属于弱电解质的是水溶液中存在电离平衡的化合物,①NH3•H2O,⑤CH3COOH 溶液中存在电离平衡,属于弱电解质,故答案为:①⑤;
(2)上述物质溶于水时,水的电离程度会减小的是①NH3•H2O 是碱抑制水的电离,⑤CH3COOH 是弱酸抑制水的电离,⑧NH4HSO4电离出氢离子抑制水的电离,
故答案为:①⑤⑧;
(3)①NH3•H2O 是弱电解质存在电离平衡,铵根离子浓度最小,
②NH4Cl 铵根离子水解溶液显酸性,
⑦NH4HCO3 溶液中碳酸氢根离子水解促进铵根离子水解,铵根离子浓度减小,
⑧NH4HSO4,溶液中氢离子抑制铵根离子水解,铵根离子浓度增大;
溶液中铵根离子浓度由大到小的顺序是⑧②⑦①,
故答案为:⑧②⑦①;
(4)碳酸氢钠溶液中,碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(5)设pH=4的H2SO4溶液XL和pH=9的NaOH溶液YL混合,当溶液中c(Na+)=2c(SO42-)时,c(H+)=c(OH-)溶液显中性,混合液的pH=7,pH=4的H2SO4溶液,c(H+)=1×10-4mol/L,pH=9的NaOH溶液,根据Kw=c(OH-)×c(H+),c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=1×10-5mol/L,若所得混合液为中性,酸碱恰好完全反应,n(H+)=n(OH-),则有1×10-4mol/L×XL=1×10-5mol/L×YL,X:Y=1:10,
故答案为:1:10.
点评 本题考查了弱电解质电离平衡、盐类水解应用、电解质溶液中离子浓度大小比较,酸碱反应溶液酸碱性判断,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,NA个H2和O2的混合气体的体积约为22.4 L | |
| B. | 1mol SiO2晶体中,含有2NA个Si-O键 | |
| C. | 0.1 mol Cl2溶解于一定体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2 L H2O所含分子数为0.5 NA |
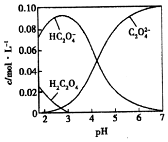 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa
C6H5CCOONa+HCl→C6H5 COOH+NaCl
相关物质物理性质如表:
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出.

仪器A的名称为三颈烧瓶(或三口烧瓶),若将仪器B改为仪器C,效果不如B,说明原因:B的接触面积大,冷却回流苯甲醛的效果好
(2)操作②有关分液漏斗的使用不正确的是CD
A.分液漏斗在使用之前必须检验矢耦漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集℃的馏分.图2中有一处明显错误,正确的应改为温度计的水银球处于蒸馏烧瓶的支管口
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用滤液 冲洗杯壁上残留的晶体.抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头.
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为96.00%.
已知:①C(s)+O2(g)═CO2(g)△H1=akJ•mol-1
②K2S(s)═S(s)+2K(s)△H2=bkJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=cJ•mol-1
下列说法正确的是( )
| A. | x>0 a<0 | |
| B. | b<o c<o | |
| C. | x=3a-b-c | |
| D. | 1mol碳(s)在空气中不完全燃烧生成CO的焓变小与akJ•mol-1 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠、碳酸氢钠 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
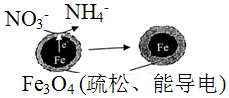
| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适 | |
| B. | 柠檬因为有酸味,所以属于酸性食品 | |
| C. | 目前加碘食盐中碘元素以KIO3形式存在 | |
| D. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 |
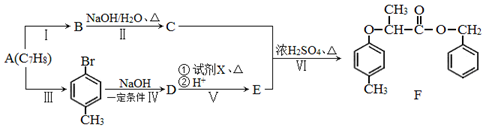
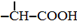 $→_{红磷、△}^{Cl_{2}}$
$→_{红磷、△}^{Cl_{2}}$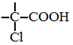
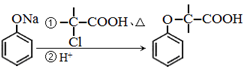
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
.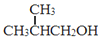 为原料制取
为原料制取 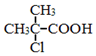 的合成路线图.
的合成路线图.