题目内容
关于以下两个电解装置的说法正确的是( )


| A、两个装置中阳极都为Al,接通电源后,均失电子发生还原反应 |
| B、两装置中阴极都为C,但由于电解质溶液不同,阴极放电离子种类不同 |
| C、电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有白色沉淀,乙中没有 |
| D、电解过程中两装置pH均不变 |
考点:电解原理
专题:
分析:A.两个装置中阳极都为Al,接通电源后,阳极上均失电子发生氧化反应;
B.根据离子的放电顺序分析,两装置中阴极都为C,阴极放电离子都为H+;
C.电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有氢氧化铝白色沉淀,乙中生成偏铝酸钠和水;
D.电解过程中甲pH增大,乙pH减小.
B.根据离子的放电顺序分析,两装置中阴极都为C,阴极放电离子都为H+;
C.电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有氢氧化铝白色沉淀,乙中生成偏铝酸钠和水;
D.电解过程中甲pH增大,乙pH减小.
解答:
解:A.电解池金属作阳极(除铂、金外),金属溶解,两个装置中阳极都为Al,所以接通电源后,电解池阳极上Al失电子Al-3e-=Al3+,发生氧化反应,故A错误;
B.在电解氯化钠、氢氧化钠溶液时,阴极上都为H+放电,电极反应式为:2H++2e-=H2↑,故B错误;
C.电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中阳极Al-3e-=Al3+,阴极2H++2e-=H2↑,Al3++3OH-=Al(OH)3↓,乙中阳极Al-3e-=Al3+,阴极Al3++4OH-=AlO2-+2H2O,甲中有氢氧化铝白色沉淀,乙中没有,故C正确;
D.根据C分析,电解过程中甲pH增大,乙pH减小,故D错误;
故选C.
B.在电解氯化钠、氢氧化钠溶液时,阴极上都为H+放电,电极反应式为:2H++2e-=H2↑,故B错误;
C.电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中阳极Al-3e-=Al3+,阴极2H++2e-=H2↑,Al3++3OH-=Al(OH)3↓,乙中阳极Al-3e-=Al3+,阴极Al3++4OH-=AlO2-+2H2O,甲中有氢氧化铝白色沉淀,乙中没有,故C正确;
D.根据C分析,电解过程中甲pH增大,乙pH减小,故D错误;
故选C.
点评:本题考查电解原理,明确发生的电极反应是解答本题的关键,注意溶液中离子的放电顺序以及氢氧化铝的两性,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
下列说法正确的是( )
| A、将浓度为0.1mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH,若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量的KOH溶液,所得溶液呈中性,该溶液中一定含KHSO2 |
| D、用0.2000mol?L-1NaOH标准溶液滴定浓度均为0.1mol?L-1的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、1mol NaCl中,Na+的核外电子总数为10NA |
| B、1molFe与过量的稀HNO3反应,转移2NA个电子 |
| C、0.1mol?L?1Na2SO4液含有0.1NA个SO42- |
| D、常温常压下,22.4L氯气与足量镁粉充分反应,生成MgCl2 2NA |
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是( )
| A、HCl(g)+NH3(g)=NH4Cl(s) |
| B、2KClO3(s)=2KCl(s)+3O2(g) |
| C、2Na2O2(s)+2H2O(l)=4NaOH(s)+O2(g) |
| D、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) |
下列实验方法合理的是( )
| A、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱物质的量相等 |
| B、在酸、碱中和滴终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 |
| C、配制0.1mol/L的盐酸500ml,应选用的仪器有:胶头滴管、烧杯、玻璃棒、天平、500ml容量瓶 |
| D、将食用盐溶于水,然后滴入淀粉溶液,来检验食盐是否是加碘食盐 |
 由于双酚A对婴儿发育、免疫力有影响,欧盟从2011年3月1日起禁止生产双酚A塑料奶瓶.双酚A简称双酚基丙烷,结构如图.下列分析不正确的是( )
由于双酚A对婴儿发育、免疫力有影响,欧盟从2011年3月1日起禁止生产双酚A塑料奶瓶.双酚A简称双酚基丙烷,结构如图.下列分析不正确的是( )| A、其分子式为C15H16O2 |
| B、它有弱酸性,且能和酸性高锰酸钾溶液反应 |
| C、它常温下呈液态,不溶于水,是苯酚的同系物 |
| D、双酚A分子中碳原子不可能在同一平面上 |


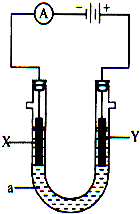 电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: