题目内容
某烯烃A是有机化学工业的基本原料,其相对分子质量为28,A可发生如图所示的一系列化学反应(部分产物已略去),其中反应①②③均属于加成反应.

请回答下列问题:
(1)写出D的结构简式 .
(2)写出④的反应类型 .
(3)写出②的化学方程式 .

请回答下列问题:
(1)写出D的结构简式
(2)写出④的反应类型
(3)写出②的化学方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:某烯烃A是有机化学工业的基本原料,其相对分子质量为28,则A为乙烯,其结构简式为CH2=CH2,A和氢气发生加成反应生成B,B结构简式为CH3CH3,B发生取代反应生成C、A和HCl发生加成反应生成C,则C结构简式为CH3CH2Cl,A和水发生加成反应生成D,则D结构简式为CH3CH2OH,A发生加聚反应生成E,则E结构简式为 ,据此分析解答.
,据此分析解答.
 ,据此分析解答.
,据此分析解答.解答:
解:某烯烃A是有机化学工业的基本原料,其相对分子质量为28,则A为乙烯,其结构简式为CH2=CH2,A和氢气发生加成反应生成B,B结构简式为CH3CH3,B发生取代反应生成C、A和HCl发生加成反应生成C,则C结构简式为CH3CH2Cl,A和水发生加成反应生成D,则D结构简式为CH3CH2OH,A发生加聚反应生成E,则E结构简式为 ,
,
(1)通过以上分析知,D为乙醇,则D的结构简式CH3CH2OH,故答案为:CH3CH2OH;
(2)④为乙烯发生加聚反应生成聚乙烯,所以该反应的反应类型是加聚反应,故答案为:加聚反应;
(3)②为乙烯和HCl生成氯乙烷的反应,所以该反应的化学方程式CH2=CH2+HCl
CH3CH2Cl,
故答案为:CH2=CH2+HCl
CH3CH2Cl.
 ,
,(1)通过以上分析知,D为乙醇,则D的结构简式CH3CH2OH,故答案为:CH3CH2OH;
(2)④为乙烯发生加聚反应生成聚乙烯,所以该反应的反应类型是加聚反应,故答案为:加聚反应;
(3)②为乙烯和HCl生成氯乙烷的反应,所以该反应的化学方程式CH2=CH2+HCl
| 一定条件下 |
故答案为:CH2=CH2+HCl
| 一定条件下 |
点评:本题考查有机推断,涉及烯烃、醇、烷、卤代烃、高聚物之间的转化,明确物质中含有官能团及物质性质即可解答,熟练掌握有机物反应类型,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
微观粒子是化学研究的主要对象.若阿伏加德罗常数为6.02×1023mol-1,下列对粒子数判断正确的是( )
| A、常温常压下,2.24L H2O2气体中含有的分子数为0.1×6.02×1023 |
| B、46 g NO2和N2O4混合气体中含有原子数为3NA |
| C、100 mL 0.2 mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023 |
| D、25℃时,纯水中含有的H+数为1×10-7×6.02×1023 |
酸性KMnO4溶液是化学实验中的一种常用强氧化剂.下列溶液中肯定不能用于酸化KMnO4溶液的是( )
| A、HNO3 |
| B、NaHSO4 |
| C、H2SO4 |
| D、HCl |
分子式是C4H10O,能发生酯化反应的有机物的同分异构体(不考虑立体异构体)共有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
关于以下两个电解装置的说法正确的是( )


| A、两个装置中阳极都为Al,接通电源后,均失电子发生还原反应 |
| B、两装置中阴极都为C,但由于电解质溶液不同,阴极放电离子种类不同 |
| C、电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有白色沉淀,乙中没有 |
| D、电解过程中两装置pH均不变 |
 (1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
(1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:

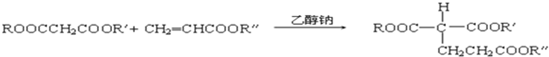 (R、R′、R″代表相同或不相同的烃基).
(R、R′、R″代表相同或不相同的烃基).