题目内容
下列实验方法合理的是( )
| A、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱物质的量相等 |
| B、在酸、碱中和滴终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 |
| C、配制0.1mol/L的盐酸500ml,应选用的仪器有:胶头滴管、烧杯、玻璃棒、天平、500ml容量瓶 |
| D、将食用盐溶于水,然后滴入淀粉溶液,来检验食盐是否是加碘食盐 |
考点:化学实验方案的评价
专题:
分析:A.为了使反应充分进行,应使一方过量,而不是使二者物质的量相等;
B.若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整;
C.浓溶液配制稀溶液,量筒量取后在烧杯中稀释,冷却、转移、定容;
D.碘单质遇淀粉变蓝色.
B.若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整;
C.浓溶液配制稀溶液,量筒量取后在烧杯中稀释,冷却、转移、定容;
D.碘单质遇淀粉变蓝色.
解答:
解:A.中和反应热的测定应使盐酸充分反应,需加入稍过量的NaOH溶液减少盐酸的挥发,减少误差,故A错误;
B.因滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整,故B正确;
C.浓溶液配制稀溶液,量筒量取后在烧杯中稀释,冷却、转移、定容,则需要仪器为胶头滴管、烧杯、玻璃棒、量筒、500mL容量瓶,故C错误;
D.碘单质遇淀粉变蓝色,食盐添加碘酸钾,故D错误.
故选B.
B.因滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整,故B正确;
C.浓溶液配制稀溶液,量筒量取后在烧杯中稀释,冷却、转移、定容,则需要仪器为胶头滴管、烧杯、玻璃棒、量筒、500mL容量瓶,故C错误;
D.碘单质遇淀粉变蓝色,食盐添加碘酸钾,故D错误.
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及中和热测定、中和滴定、溶液配制、物质检验等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
分子式是C4H10O,能发生酯化反应的有机物的同分异构体(不考虑立体异构体)共有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
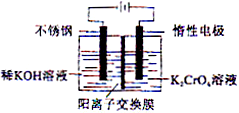
关于以下两个电解装置的说法正确的是( )


| A、两个装置中阳极都为Al,接通电源后,均失电子发生还原反应 |
| B、两装置中阴极都为C,但由于电解质溶液不同,阴极放电离子种类不同 |
| C、电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有白色沉淀,乙中没有 |
| D、电解过程中两装置pH均不变 |
实验室将18.7g量的Al和 Fe2O3混合粉末发生铝热反应之后,反应后的固体混合物恰好能 溶于1L 0.7 mol/L的盐酸,与此同时放出了标况下1.12L的H2,则有关该混合粉末Al和Fe2O3的说法不正确的是( )
| A、粉末中含有的Al和Fe2O3的物质的量之比为1:1 |
| B、铝热反应后的固体混合物只有Al2O3和Fe |
| C、溶于盐酸后所得的溶液中只有FeCl2和AlCl3 |
| D、若将该Al和 Fe2O3粉末直接投入到足量的氢氧化钠中可产生3.36L H2 |
下列实验方案设计中,可行的是( )
| A、用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
| B、除去混在镁粉中的少量铝粉,加氢氧化钠溶液后过滤 |
| C、由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、强酸性的溶液中 C6H5O-、K+、SO42-、Br- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、强碱性的溶液中 NO3-、I-、Na+、AlO2- |
 (1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
(1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:

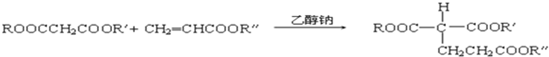 (R、R′、R″代表相同或不相同的烃基).
(R、R′、R″代表相同或不相同的烃基).