题目内容
16.通常情况下,将1体积98%的浓硫酸(密度ρg/cm3)与5体积的水混合得到一种稀硫酸,该硫酸(密度d g/cm3)物质的量浓度为$\frac{10ρd}{p+5}$mol/L.分析 假设浓硫酸体积为1L、水体积为5L,浓硫酸的物质的量=$\frac{1000mL×ρg/mL×98%}{98g/mol}$=10ρmol,溶液体积=$\frac{1000mL×ρg/mL+5000mL×1g/mL}{dg/mL}$=$\frac{1000ρ+5000}{d}mL$=$\frac{ρ+5}{d}$L,
混合溶液物质的量浓度c=$\frac{n}{V}$.
解答 解:假设浓硫酸体积为1L、水体积为5L,浓硫酸的物质的量=$\frac{1000mL×ρg/mL×98%}{98g/mol}$=10ρmol,溶液体积=$\frac{1000mL×ρg/mL+5000mL×1g/mL}{dg/mL}$=$\frac{1000ρ+5000}{d}mL$=$\frac{ρ+5}{d}$L,
混合溶液物质的量浓度c=$\frac{n}{V}$=$\frac{10ρmol}{\frac{ρ+5}{d}L}$=$\frac{10ρd}{p+5}$mol/L,
故答案为:$\frac{10ρd}{p+5}$mol/L.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生计算能力,明确“溶液体积不等于浓硫酸和水体积之和“是解本题关键,注意体积单位换算,为易错题.

练习册系列答案
相关题目
6.下面叙述正确的是( )
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
7.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为3NA |
4.室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | K+、Na+、Cl-、NO3- | B. | Al3+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、Cl-、AlO2- | D. | K+、NH4+、SO42-、NO3- |
11.对于可逆反应A(g)+3B(s)?2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=0.1mol/(L•s) | D. | υ(D)=0.4mol/(L•min) |
1.下列方法中,可制得Cl2的正确组合是( )
①MnO2和浓盐酸混合共热 ②KMnO4和浓盐酸混合 ③NaClO和浓盐酸混合
④K2Cr2O7和浓盐酸混合 ⑤KClO3和浓盐酸混合.
①MnO2和浓盐酸混合共热 ②KMnO4和浓盐酸混合 ③NaClO和浓盐酸混合
④K2Cr2O7和浓盐酸混合 ⑤KClO3和浓盐酸混合.
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
7.已知化学反应:O2(g)+2SO2(g)?2SO3(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$.
(2)某温度下,平衡浓度符合下式:c2(SO3)=c(O2)•c2(SO2),试判断此时的温度为830℃.
(3)设在一定体积的密闭容器中充入0.30mol O2(g)和0.60mol SO2(g),反应在一定条件下达到平衡时,SO3的物质的量分数(SO3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$,该条件下O2的平衡转化率为$\frac{2}{3}$;该条件下反应2SO3(g)?O2(g)+2SO2(g)的平衡常数K=40.
(4)当O2与SO2混合气体以不同比例混合时,测得其平均相对分子质量分别为57.6和44.8,取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,分别求出O2在上述混合气体中的体积分数20%、60%.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$.
(2)某温度下,平衡浓度符合下式:c2(SO3)=c(O2)•c2(SO2),试判断此时的温度为830℃.
(3)设在一定体积的密闭容器中充入0.30mol O2(g)和0.60mol SO2(g),反应在一定条件下达到平衡时,SO3的物质的量分数(SO3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$,该条件下O2的平衡转化率为$\frac{2}{3}$;该条件下反应2SO3(g)?O2(g)+2SO2(g)的平衡常数K=40.
(4)当O2与SO2混合气体以不同比例混合时,测得其平均相对分子质量分别为57.6和44.8,取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,分别求出O2在上述混合气体中的体积分数20%、60%.
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为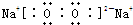 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题: