题目内容
8.Ⅰ.某化学兴趣小组用以下装置探究SO2的某些化学性质.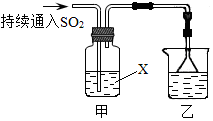
(1)装置乙的作用是吸收多余的SO2.
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有c(填序号,下同);
若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有a;
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
□Ca2++□ClO-+□SO2+□H2O=□CaSO4↓+□Cl-+□SO42-+□4H+.
Ⅱ.某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验.
i.取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液.
(4)搅拌的目的是使碘化铅充分溶解.
(5)取少量滤液于试管中,向其中滴加几滴0.1mol•L-1KI溶液,观察到的现象是产生黄色沉淀或黄色浑浊.
ii.准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出溶液用滴定法测得n(H+)=3.000×10-5 mol.
(6)在此实验温度下,PbI2的溶度积常数Ksp=1.35×10-8.若步骤 i盛装滤液的烧杯中有少量水,Ksp测定结果将会偏小(填“偏大”、“偏小”或“无影响”).
分析 Ⅰ.(1)二氧化硫为有毒气体,需要对二氧化硫进行吸收处理;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫具有氧化性,与Na2S反应生成单质硫,据此进行解答;
(3)生成的白色沉淀为硫酸钙,根据化合价升降相等对该反应进行配平;
Ⅱ.(4)固体溶解时要用玻璃杯搅拌加速溶解;
(5)根据碘化铅沉淀溶解平衡移动分析;
(6)根据Ksp(PbI2)=c(Pb2+)×c2(I-),结合离子的浓度计算;若步骤Ⅰ盛装滤液的烧杯中有少量水,则滤液的浓度减小,求出的Ksp偏小.
解答 解:Ⅰ.(1)由于二氧化硫是一种有毒气体,能够污染大气,需要对其完全进行吸收,所以装置乙为尾气处理装置,吸收多余的SO2 ,
故答案为:吸收多余的SO2;
(2)若X为品红溶液,观察到溶液褪色,说明二氧化硫具有漂白性,能够漂白品红溶液;若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,淡黄色为单质硫,二氧化硫中S的化合价为+4价,反应变成了0价,二氧化硫的化合价降低被还原,说明二氧化硫具有氧化性,
故答案为:c;a;
(3)Ca(ClO)2与二氧化硫的反应中,二氧化硫被氧化成硫酸根离子,硫酸根离子与钙离子反应生成硫酸钙沉淀;ClO-中Cl的化合价为+1价,反应后变成氯离子,化合价降低了2价,根据硫酸钙的化学式组成可知,次氯酸根离子计量数至少为2,反应化合价至少降低4价;二氧化硫化合价为+4价,反应后变成+6价,化合价升高2价,化合价变化的最小公倍数为4,所以次氯酸离子的计算量为2,二氧化硫的计量数为2,再利用观察法配平,配平后的离子方程式为:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+,
故答案为:1,2,2,2,1,2,1,4H+;
Ⅱ.(4)固体溶解时要用玻璃杯搅拌加速溶解,所以搅拌的目的是使碘化铅充分溶解,故答案为:使碘化铅充分溶解;
(5)碘化铅饱和溶液中存在沉淀溶解平衡,向滤液中滴加几滴0.1mol•L-1 KI溶液,则碘离子浓度增大,沉淀溶解平衡逆移,溶液中c(Pb2+)减小,溶液中会析出沉淀,所以观察到的现象为:产生黄色沉淀或黄色浑浊,
故答案为:产生黄色沉淀或黄色浑浊;
(6)准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5mol,则n(Pb2+)=1.500×10-5mol,所以c(Pb2+)=$\frac{1.5000×1{0}^{-5}mol}{0.01L}$=1.500×10-3mol/L,所以c(I-)=2c(Pb2+)=3.000×10-3mol/L,
所以Ksp(PbI2)=c(Pb2+)×c2(I-)=1.35×10-8;
若步骤Ⅰ盛装滤液的烧杯中有少量水,则滤液的浓度减小,量取10.00mL滤液,则滤液中碘离子和铅离子的物质的量偏小,所以求出的Ksp偏小,
故答案为:1.35×10-8;偏小.
点评 本题考查了二氧化硫的性质、氧化还原反应方程式的配平,题目难度中等,注意掌握二氧化硫具有漂白性、氧化性和还原性,明确配平氧化还原反应方程式的方法.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| 温度 n(CO) 时间 | 0 | 10 | 20 | … | 40 | 50 |
| T1 | 1.0 | 0.7 | 0.5 | … | 0.25 | 0.25 |
| T2 | 1.0 | 0.65 | 0.4 | … | 0.28 | 0.28 |
| A. | T1温度下平衡后恒容再充入0.5molCO,重新平衡后CO总的转化率与H2相等 | |
| B. | T1温度下10-20sH2的反应速率为0.04mol•L-1•s-1 | |
| C. | 该反应的△Η>0 | |
| D. | T2温度下平衡后恒定压强不变充入0.28molCH3OH,CH3OH的体积分数不变 |
| A. | H、Na | B. | N、Cl | C. | Mg、Si | D. | O、S |
| A. | 200 mL | B. | 300 mL | C. | 600 mL | D. | 700 mL |
| A. | 漂白粉 | B. | 氯水 | C. | 液氯 | D. | 水玻璃 |
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| C. | NaCl晶体是由Na+和Cl-组成,NaCl晶体是良导体 | |
| D. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
| 实验① | 实验② | 实验③ |
| 将铁钉放入硫酸 铜溶液中 | 向硫酸亚铁溶液中 滴入几滴浓硝酸 | 将铜丝放入 氯化铁溶液中 |
| A. | 可以用实验①的方法冶炼铜 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |