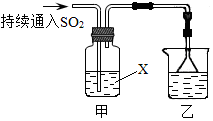
题目内容
17.已知下述三个实验均能发生化学反应:| 实验① | 实验② | 实验③ |
| 将铁钉放入硫酸 铜溶液中 | 向硫酸亚铁溶液中 滴入几滴浓硝酸 | 将铜丝放入 氯化铁溶液中 |
| A. | 可以用实验①的方法冶炼铜 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
分析 ①中发生Fe+Cu2+═Fe2++Cu,②中发生3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,③中发生Cu+2Fe3+═2Fe2++Cu2+,利用化合价变化判断氧化剂、还原剂,并利用氧化剂的氧化性大于氧化产物的氧化性来比较氧化性的强弱.
解答 解:A.由①中发生Fe+Cu2+═Fe2++Cu,可以用实验①的方法冶炼铜,故A正确;
B.3Fe2++4H++NO3-═3Fe3++NO↑+2H2O中Fe元素的化合价升高,则Fe2+只能表现还原性,故B错误;
C、置换反应是单质与化合物反应生成新单质和新化合物,而③中发生Cu+2Fe3+═2Fe2++Cu2+,生成物中没有单质,则不是置换反应,故C错误;
D、由发生的三个反应,利用氧化剂的氧化性大于氧化产物的氧化性,则上述实验证明氧化性为Fe3+>Cu2+>Fe2+,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应基本概念及应用,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | lmol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023 | |
| B. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 稀释0.1 mol•L-1CH3COOH溶液,溶液中所有离子浓度均减小 | |
| D. | 铅蓄电池在充电过程中,两极质量都增大 |
5.按碳骨架分类,下列说法正确的是( )
| A. | CH3CH(CH3)2 属于链状化合物 | B. | 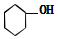 属于酚类化合物 | ||
| C. | 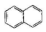 属于苯的同系物 | D. | 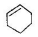 属于芳香族化合物 |
2.化学与生活密切相关,下列生活中常见的物质的俗名与化学式相对应的是( )
| A. | 苏打--NaHCO3 | B. | 胆矾--CuSO4 | ||
| C. | 磁性氧化铁--Fe3O4 | D. | 生石灰--CaCO3 |
9.既属于钠盐,有属于硫酸盐的物质是( )
| A. | Na2SO3 | B. | Na2SO4 | C. | K2SO4 | D. | NaHSO4 |
6.下列有关叙述正确的是( )
| A. | 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 | |
| B. | 同体积、同密度的C2H4和CO,两种气体的分子数一定相等 | |
| C. | 配制450ml0.1mol•L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g | |
| D. | 1L0.45mol•L-1NaCl溶液中Cl-的物质的量浓度比0.1L0.15mol•L-1AlCl3溶液大 |
7.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 配制CuSO4溶液 | 将硫酸铜晶体溶于热水中,然后稀释 |
| B | 除去试管内壁的银镜 | 加入浓氨水浸泡,再用蒸馏水洗涤 |
| C | 提纯含少量乙酸的乙醇(乙醇沸点78.5℃) | 加入生石灰后进行蒸馏,收集78.5℃馏分 |
| D | 证明HClO为弱酸 | 用洁净的玻璃棒蘸取NaClO溶液在pH试纸上,待试纸变色后与标准比色对照 |
| A. | A | B. | B | C. | C | D. | D |