题目内容
17.Ga(镓)、P、As都是形成化合物半导体材料的重要元素.(1)基态As原子的电子占据了18个原子轨道,最高能层的电子排布式为4s24p3,和砷位于同一周期,且未成对电子数也相同的元素名称是钒、钴.
(2)NH3、PH3、AsH3三者的沸点由高到低的顺序为NH3>AsH3>PH3(填化学式),原因是NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物范德华力强,沸点高;
(3)白磷分子(P4)是正四面体结构,P原子的杂化方式为sp3;
(4)采用GaxIn(1-x)As(镓 铟 砷)等材料,可提高太阳能电池的效率.GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有4个砷原子.已知晶胞边长为apm,阿伏加德罗常数为NA,则晶胞密度为$\frac{4×[75+70x+115(1-x)]}{(a×1{0}^{-10})^{3}×{N}_{A}}$g/cm3(只列计算式,不必化简).
分析 (1)基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3;和砷位于同一周期,且未成对电子数也相同的元素,它们的外围电子排布式为:3d34s2、3d74s2;
(2)NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物范德华力强,沸点高;
(3)白磷分子(P4)是正四面体结构,P原子形成3个P-P键、含有1对孤对电子,杂化轨道数目为4;
(4)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,由化学式可知晶胞中As数目占原子总数的$\frac{1}{2}$;晶胞中Ga原子数目为4x,In原子数目为4(1-x),计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3,占据原子轨道数目为:1×4+3×3+5=18,最高能层的电子排布式为4s24p3,和砷位于同一周期,且未成对电子数也相同的元素,它们的外围电子排布式为:3d34s2、3d74s2,分别为钒、钴,
故答案为:18;4s24p3;钒;钴;
(2)NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物范德华力强,沸点高,故沸点:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物范德华力强,沸点高;
(3)白磷分子(P4)是正四面体结构,P原子形成3个P-P键、含有1对孤对电子,杂化轨道数目为4,P原子的杂化方式为sp3,
故答案为:sp3;
(4)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,由化学式可知晶胞中As数目占原子总数的$\frac{1}{2}$,即晶胞中As原子数目为8×$\frac{1}{2}$=4,晶胞中Ga原子数目为4x,In原子数目为4(1-x),则晶胞质量=4×$\frac{75+70x+115(1-x)}{{N}_{A}}$g,晶胞密度=4×$\frac{75+70x+115(1-x)}{{N}_{A}}$g÷(a×10-10cm)3=$\frac{4×[75+70x+115(1-x)]}{(a×1{0}^{-10})^{3}×{N}_{A}}$g•cm-3,
故答案为:4;$\frac{4×[75+70x+115(1-x)]}{(a×1{0}^{-10})^{3}×{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、氢键、杂化方式判断、晶胞计算等,(4)中计算为易错点,关键是结合化学式、均摊法计算晶胞中原子数目.

 习题精选系列答案
习题精选系列答案实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
a.热量关系:a+b=92.4
b.三个容器内反应的平衡常数:③>①=②
c.平衡时氨气的体积分数:①=②>③
d.①N2的转化率+②NH3的转化率=100%
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
| A. | Na+、K+、$S{O_4}^{2-}$、$HC{O_3}^-$ | B. | Cu2+、K+、$S{O_4}^{2-}$、$N{O_3}^-$ | ||
| C. | Na+、K+、Cl-、$S{O_4}^{2-}$ | D. | Fe2+、K+、$N{O_3}^-$、$C{H_3}CO{O^-}$ |
| A. | ClO2是还原产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1molKClO3参加反应,转移电子物质的量为1mol | |
| D. | 生成5.6LCO2,转移的电子数目为0.25NA |
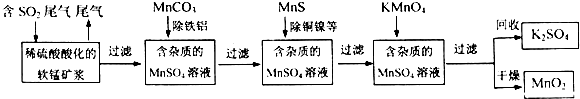
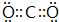 .
.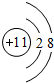 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式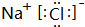 .
. (1)苯分子中的碳碳之间的化学键是一种独特的键,因此其化学性质一般表现
(1)苯分子中的碳碳之间的化学键是一种独特的键,因此其化学性质一般表现