题目内容
6.下列对实验室中试剂储存的有关说法不正确的是( )| A. | 金属钠存放在试剂瓶中的煤油里 | |
| B. | 存放液溴的试剂瓶中应加水封 | |
| C. | 硝酸应用棕色瓶盛装且避光存放 | |
| D. | 烧碱应盛放在玻璃塞的磨口玻璃瓶中 |
分析 A.金属钠能与空气中的氧气和水反应;
B.液溴易挥发;
C.浓硝酸见光易分解;
D.玻璃的主要成分是二氧化硅.
解答 解:A.因金属钠能与空气中的氧气和水反应,须贮存在煤油中隔离空气,故A正确;
B.因液溴易挥发,保存溴时应加入少量水,故B正确;
C.因浓硝酸易分解,须存放在棕色试剂瓶中,故C正确;
D.因烧碱溶液能与玻璃中的二氧化硅反应生成具有粘和合性的硅酸钠,容易将瓶口和瓶塞粘结在一起,故烧碱溶液盛放在带橡皮塞的玻璃瓶中,故D错误;
故选D.
点评 本题主要考查了物质的保存方法,难度不大,掌握物质的性质是解题的关键.

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
6.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白.NaClO2溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氧微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )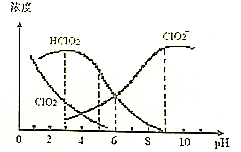

| A. | 向亚氯酸钠溶液加水稀释,溶液中n(ClO2)增大 | |
| B. | HClO2的电离平衡常数Ka=1.0×10-6 | |
| C. | NaClO2溶液中:c(Na+)+c(H+)>c(ClO2-)+c(Cl-) | |
| D. | pH=5时含氯元素的微粒浓度大小关系为:c(HClO2)>c(ClO2-)>c(Cl-)>c(ClO2) |
17.下列分离方法不正确的是( )
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用分液的方法分离食盐水和汽油的混合物 |
14.如图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图.据图判断下列说法不正确的是( )


| A. | 标准状况下,生成22.4LCl2的同时有2molNaOH生成 | |
| B. | 从C口流出的是NaOH溶液 | |
| C. | 从E口逸出的气体是H2 | |
| D. | 从F口逸出的气体是Cl2 |
11.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )
| A. | x=1 | |
| B. | 2 min内A的反应速率为0.3 mol/(L•min) | |
| C. | B的转化率为40% | |
| D. | 若混合气体的密度不变,则表明该反应达到平衡状态 |
15.小东欲配制含有大量下列各离子的溶液,其中能实现的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | Na+、Cu2+、Cl-、SO42- |
16.1L 0.1mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断中正确的是( )
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |