题目内容
3.下列实验“操作和现象”与“结论”对应关系正确的是( )| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NO3-在酸性条件下具有氧化性,被还原生成NO,NO被O2氧化为红棕色的NO2;
B.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应;
C.相同温度、溶剂下,碳酸氢钠的溶解度小于碳酸钠的溶解度;
D.乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,SO2具有还原性,也可以使酸性KMnO4溶液褪色.
解答 解:A.向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A错误;
B.应加入碱将水解后的淀粉溶液调节成碱性,才可以产生红色沉淀,故B错误;
C.饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,故C正确;
D.乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,也可以使酸性KMnO4溶液褪色,故D错误.
故选C.
点评 本题考查化学实验方案的评价,注意物质的性质和物质的检验方法,排除其它因素的干扰,题目难度不大.

练习册系列答案
相关题目
14.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式为:C2H4 | |
| B. | S2-的结构示意图: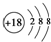 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | NH4Cl的电子式为: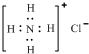 |
18.标准状况下88gCO2有( )
| A. | 3NA个原子 | B. | NA个分子 | C. | 2.0mol分子 | D. | 11.2L |
12.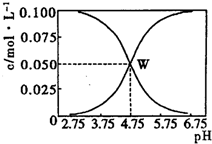 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 由题给图示可求出25℃时醋酸的电离平衡常数Ka=10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH))+c(OH-) |
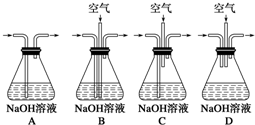 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.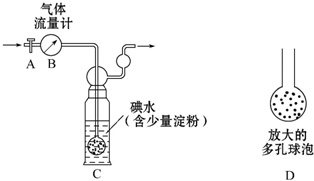
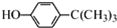 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: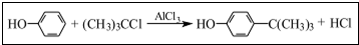 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.