题目内容
5.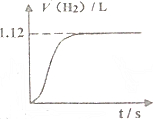 常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)
常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)请计算:
(1)常温HA的电离常数Ka约为10-5
(2)常温下0.001mol•L-1HA溶液的pH约为4.
分析 (1)根据图象可知,生成的氢气为1.12L,其物质的量为0.05mol,则酸的物质的量为0.1mol,结合电离常数的表达式计算;
(2)根据电离常数计算溶液中的氢离子浓度,然后计算pH.
解答 解:(1)根据图象可知,生成的氢气为1.12L,其物质的量为0.05mol,则酸的物质的量为0.1mol,所以c(HA)=$\frac{0.1mol}{1L}$=0.1mol/L,
则Ka=$\frac{c({H}^{+})×c({A}^{-})}{c(HA)}$=$\frac{0.001×0.001}{0.1-0.001}$≈10-5,
故答案为:10-5;
(2)常温下0.001mol•L-1HA溶液中氢离子浓度c(H+)=$\sqrt{Ka×c(HA)}$=$\sqrt{1{0}^{-5}×0.001}$=10-4mol/L,所以溶液的pH=4;
故答案为:4.
点评 本题考查了弱电解的电离和电离常数的计算,注意把握电离常数的表达式以及计算方法,题目难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
18.某兴趣小组欲配置一定浓度的NaOH溶液,下列说法不正确的是( )
| A. | 需要配置480mL该溶液,应选用500mL容量瓶 | |
| B. | 固体NaOH须放到烧杯中称量 | |
| C. | 把称好的固体加水溶解后马上转移到容量瓶中 | |
| D. | 定容时俯视刻度线,所配NaOH溶液浓度会偏大 |
10.煤化工中常将研究不同温度下的平衡常数,投料比及产率等问题,已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
| 温度℃ | 400 | 500 | 830 | 1000 |
| 平均常数K | 10 | 9 | 1 | 0.6 |
| A. | 上述反应中正反应是吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{\{c({H}_{2})•c(C{O}_{2})\}}{\{c(CO)•c({H}_{2}O)\}}$ | |
| C. | 该反应在400℃时达平衡状态,若升高温度,则正反应速率减小,逆反应速率增大 | |
| D. | 在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,在达到平衡前V(正)<V(逆) |
17.工业甲醛测定的一种方法是:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定,(已知H2O2也能氧化甲酸)①HCHO+H202→HCOOH+H20 ②NaOH+HCOOH→HCOONa+H20,下列有关说法正确的是( )
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量-定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化甲醛(反应①)和氧化甲酸的原理相同,氧化等量甲醛和甲酸时转移电子的数目也相同 |
14.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式为:C2H4 | |
| B. | S2-的结构示意图: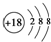 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | NH4Cl的电子式为: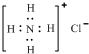 |
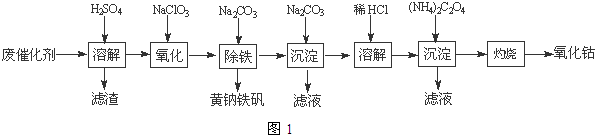
 (4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次. 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.