题目内容
氨在国民经济中占有重要的地位,请参与下列探究.
(1)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0的平衡常数K=0.5,
①400℃时,2NH3(g)?N2 (g)+3H2(g)的平衡常数K= (填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、
1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(2)有两只密闭容器A和B,A能保持恒容,B能保持恒压.起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g)?N2 (g)+3H2(g),并达到平衡.
①达到平衡所需要的时间:t(A) t(B),NH3的转化率:a(A) a(B)(填>、=、<).
②达到平衡后,在两容器中分别通入等量的氦气.则B中的化学平衡向 反应方向移动,A中的化学反应速率 (填“增大”、“减小”或“不变”).
③达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量 (填“增大”、“减小”或“不变”).
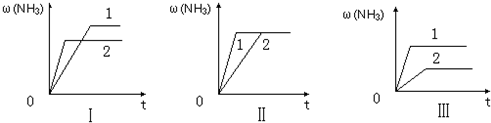
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是 (填字母).
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能,1>2
(1)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0的平衡常数K=0.5,
①400℃时,2NH3(g)?N2 (g)+3H2(g)的平衡常数K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、
1mol、2mol,则此时反应V(N2)正
(2)有两只密闭容器A和B,A能保持恒容,B能保持恒压.起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g)?N2 (g)+3H2(g),并达到平衡.
①达到平衡所需要的时间:t(A)
②达到平衡后,在两容器中分别通入等量的氦气.则B中的化学平衡向
③达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能,1>2

考点:化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系;
②根据浓度熵和平衡常数之间的关系来判断反应的状态;
(2)反应2NH3(g)?N2 (g)+3H2(g),正方向为体积增大的分方向,A容器能保持恒容,则反应后压强增大,B容器能保持恒压,反应后体积增大;
①根据压强大小,判断速率大小;根据压强对平衡的影响分析;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,根据反应物浓度变化分析;
③达到平衡后,向两容器中分别通入等量的原反应气体,根据压强对平衡的影响分析;
(3)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
②根据浓度熵和平衡常数之间的关系来判断反应的状态;
(2)反应2NH3(g)?N2 (g)+3H2(g),正方向为体积增大的分方向,A容器能保持恒容,则反应后压强增大,B容器能保持恒压,反应后体积增大;
①根据压强大小,判断速率大小;根据压强对平衡的影响分析;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,根据反应物浓度变化分析;
③达到平衡后,向两容器中分别通入等量的原反应气体,根据压强对平衡的影响分析;
(3)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
解答:
解:(1)①反应N2(g)+3H2(g)?2NH3(g)和反应2NH3(g)?N2(g)+3H2(g)是互为可逆反应,平衡常数互为倒数,
已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0的平衡常数K=0.5,
则2NH3(g)?N2(g)+3H2(g)的平衡常数是2;
故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=
=0.5=K,所以该状态是平衡状态,正逆反应速率相等;
故答案为:=;
(2)反应2NH3(g)?N2 (g)+3H2(g),正方向为体积增大的分方向,A容器能保持恒容,则反应后压强增大,B容器能保持恒压,反应后体积增大;
①A容器能保持恒容,则反应后压强增大,B容器能保持恒压,所以A中的压强大于B,压强越大,反应速率越快,所用时间越短,则所用时间A小于B;压强增大平衡向逆反应方向移动,所以压强越大,转化率越小,A的压强大,则A的转化率小于;
故答案为:<;<;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,则A中各反应物质的浓度不变,A中反应速率不变,B中各反应物浓度减小,各反应物所占的压强减小,平衡正移;
故答案为:正;不变;
③达到平衡后,向两容器中分别通入等量的原反应气体,A中压强增大,新平衡原平衡相比,平衡逆向进行,则A中氢气的含量减小;
故答案为:减小;
(3)A.增大压强平衡右移,氨气的含量应增大,图象与实际不符,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,图象与实际不符,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,图象与实际不符,故C错误;
D.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故D正确.
故答案为:D.
已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0的平衡常数K=0.5,
则2NH3(g)?N2(g)+3H2(g)的平衡常数是2;
故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=
| 4×4 |
| 4×22 |
故答案为:=;
(2)反应2NH3(g)?N2 (g)+3H2(g),正方向为体积增大的分方向,A容器能保持恒容,则反应后压强增大,B容器能保持恒压,反应后体积增大;
①A容器能保持恒容,则反应后压强增大,B容器能保持恒压,所以A中的压强大于B,压强越大,反应速率越快,所用时间越短,则所用时间A小于B;压强增大平衡向逆反应方向移动,所以压强越大,转化率越小,A的压强大,则A的转化率小于;
故答案为:<;<;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,则A中各反应物质的浓度不变,A中反应速率不变,B中各反应物浓度减小,各反应物所占的压强减小,平衡正移;
故答案为:正;不变;
③达到平衡后,向两容器中分别通入等量的原反应气体,A中压强增大,新平衡原平衡相比,平衡逆向进行,则A中氢气的含量减小;
故答案为:减小;
(3)A.增大压强平衡右移,氨气的含量应增大,图象与实际不符,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,图象与实际不符,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,图象与实际不符,故C错误;
D.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故D正确.
故答案为:D.
点评:本题考查考查平衡常数的计算、化学平衡移动的问题等,侧重于化学平衡移动的综合考查,题目难度中等,注意把握平衡常数的意义.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某有机物分子中含一个苯基、一个甲基和一个羟基,符合这种结构的酚类物质共有( )
| A、6种 | B、5种 | C、4种 | D、3种 |

 △H1=-125KJ/mol
△H1=-125KJ/mol
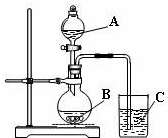 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.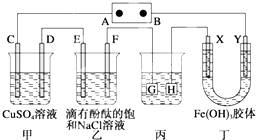 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答: