题目内容
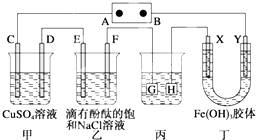 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:(1)B极是电源的
(2)乙装置中发生的总反应离子方程式为
(3)若甲、乙装置中的C、D、E电极均只有一种单质生成时,对应单质的物质的量之比为
(4)现用丙装置给铜件镀银,则H应该是
(5)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是:
考点:电解原理
专题:电化学专题
分析:(1)将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F即是阴极,并得到其他各个电极的名称,硫酸铜中铜离子减少导致溶液颜色的变化,胶体的胶粒带点电,即电泳实验证明的结论;
(2)根据电解质的工作原理确定方程式的书写;
(3)C、D、E电极转移的电子数目相等,根据转移电子数可计算生成的单质的量,;
(4)电镀装置中,镀层金属必须做阳极,镀件做阴极,各个电极上转移的电子数是相等的;
(5)铁电极做阳极则该电极放电的是金属铁本身.
(2)根据电解质的工作原理确定方程式的书写;
(3)C、D、E电极转移的电子数目相等,根据转移电子数可计算生成的单质的量,;
(4)电镀装置中,镀层金属必须做阳极,镀件做阴极,各个电极上转移的电子数是相等的;
(5)铁电极做阳极则该电极放电的是金属铁本身.
解答:
解:将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
(1)B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,故答案为:负极;氢氧化铁胶体粒子带正电荷;
(2)以惰性电极电解饱和食盐水的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(3)C、D、E电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2,故答案为:1:2:2;
(4)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-═H2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,故答案为:镀件;5.4;
(5)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+
Cu+Fe2+,故答案为:Fe+Cu2+
Cu+Fe2+.
(1)B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,故答案为:负极;氢氧化铁胶体粒子带正电荷;
(2)以惰性电极电解饱和食盐水的离子方程式为:2Cl-+2H2O
| ||
| ||
(3)C、D、E电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2,故答案为:1:2:2;
(4)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-═H2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,故答案为:镀件;5.4;
(5)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+
| ||
| ||
点评:本题考查学生有关电解池的工作原理知识,综合性很强,难度较大,要求学生熟记教材知识,学以致用.

练习册系列答案
相关题目
已知硒(Se)与氧同主族,与钾同周期,下列有关硒元素的描述错误的是( )
| A、硒的非金属性比硫弱 |
| B、硒的最高价氧化物对应水化物的化学式是H2SeO4 |
| C、硒的氧化物只以SeO3形式存在 |
| D、硒的氢化物以H2Se形式存在 |
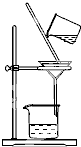 如图所示是粗盐提纯实验操作步骤,其名称为
如图所示是粗盐提纯实验操作步骤,其名称为