题目内容
16. A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:(1)C原子的核外电子排布式为1s22s22p63s23p4,E的价电子轨道表示式为
 .
.(2)A、B、C中第一电离能最大的是N(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是sp3.A的氢化物(AH3)分子极易溶于水的原因NH3分子与水分子之间形成氢键,且氨气分子与水分子都是极性分子,相似相溶
(3)化合物D2B的立体构型为V形,单质D与湿润的Na2CO3反应可制备D2B,同时还生成两种厨房中常用的物质,其化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
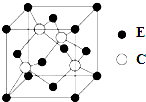
(4)E与C所形成化合物的立方晶胞如图所示.
①在1个晶胞中,E离子的数目为4.
②该化合物的化学式为ZnS.
③晶胞中两个E原子间的最短距离是a cm求该晶胞的密度$\frac{87}{\sqrt{2}{a}^{3}{N}_{A}}$ g/cm3.
分析 A、B、C、D、E为原子序数依次增大的四种元素,B的最外层电子数为其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;A的价电子层中的未成对电子有3个,原子序数小于氧,则核外电子排布式为1s22s22p3,故A为N元素;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,C原子核外电子排布式1s22s22p63s23p4,故C为S元素,D元素最外层有一个未成对电子,则D为Cl元素;E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,原子核外电子数为2+8+18+2=30,故E为Zn.
解答 解:A、B、C、D、E为原子序数依次增大的四种元素,B的最外层电子数为其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;A的价电子层中的未成对电子有3个,原子序数小于氧,则核外电子排布式为1s22s22p3,故A为N元素;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,C原子核外电子排布式1s22s22p63s23p4,故C为S元素,D元素最外层有一个未成对电子,则D为Cl元素;E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,原子核外电子数为2+8+18+2=30,故E为Zn.
(1)C元素基态原子的3p轨道上有4个电子,原子核外电子排布式为1s22s22p63s23p4,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,价电子排布式为:3d104s2,价电子轨道表示式为 ,
,
故答案为:1s22s22p63s23p4; ;
;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,同主族自上而下第一电离能减小,故第一电离能:N>O>S,
NH3分子中,N原子形成3个键,含有1对孤对电子,N原子杂化轨道数目为4,故N原子采取sp3杂化,
NH3分子与水分子之间形成氢键,且氨气分子与水分子都是极性分子,相似相溶,故氨气极易溶于水,
故答案为:N;sp3;NH3分子与水分子之间形成氢键,且氨气分子与水分子都是极性分子,相似相溶;
(3)化合物Cl2O中O原子孤电子对数=$\frac{6-1×2}{2}$=2,价层电子对数=2+2=4,故其空间构型为V形,单质氯气与湿润的Na2CO3反应可制备Cl2O,同时还生成两种厨房中常用的物质,即生成碳酸氢钠与氯化钠,其化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,
故答案为:V形;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(4)①在1个晶胞中,E离子处于晶胞顶点与面心,晶胞中E离子的数目为为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:4;
②晶胞中S原子数目为4,Zn原子数目为4,则晶体化学式为ZnS,
故答案为:ZnS;
③晶胞质量为4×$\frac{65+32}{{N}_{A}}$g,两个E原子间的最短距离是a cm,则晶胞面对角线上长度为2a cm,则晶胞棱长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a cm,故该晶胞的密度为4×$\frac{65+32}{{N}_{A}}$g÷($\sqrt{2}$a cm)3=$\frac{87}{\sqrt{2}{a}^{3}{N}_{A}}$ g/cm3,
故答案为:$\frac{87}{\sqrt{2}{a}^{3}{N}_{A}}$g/cm3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间构型与杂化方式、氢键、晶胞计算等,(4)中关键是计算晶胞棱长,掌握均摊法进行晶胞有关计算,注意同周期第一电离能异常情况.

| A. | 冰-混合物 | B. | 纯碱-盐 | ||
| C. | 澄清石灰水-纯净物 | D. | 洁净的空气-纯净物 |
| A. | CuSO4 | B. | CO2 | C. | HCl | D. | CH3CH2OH |
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)HNO2在溶液中的电离方程式为HNO2?H++NO2-
(3)25℃时,W溶液的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
| A. | Cl的最高氧化物对应的水化物酸性最强 | |
| B. | S元素的族序数等于周期数3倍 | |
| C. | C元素的最高正价与最低负价代数和为零 | |
| D. | N元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应 |
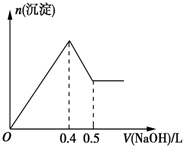 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )