题目内容
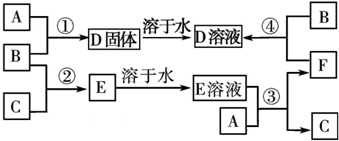
 如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:
如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:(1)判断电源的正、负极:X为
(2)写电极反应式:A中
(3)若电解一段时间后,A、B中均有气体包围电极,此时切断开关S2,闭合开关S1,则电流计的指针是否发生偏转?(填“偏转”或“不偏转”)
(4)若电流计指针偏转,写出B中的电极反应式(若指针“不偏转”,此题不必回答),B中
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极.切断电源开关S1,闭合开关S2,因为A试管中气体体积是B试管中的2倍,所以A中为H2,B中为O2,即A为阴极,B为阳极,所以x为正极,y为负极,C与电源正极相连,为阳极,电极反应方程式为2I--2e-=I2,B电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑,如果切断S2,闭合S1,则可由A中的H2,B中的O2与KOH溶液形成H2-O2燃料电池,氢气一极是负极,氧气一极是正极.
解答:
解:(1)惰性电极电解KOH溶液,实质就是电解水,所得产物为H2和O2,因为A试管中气体体积是B试管中的2倍,所以A中为H2,B中为O2,即A为阴极,B为阳极,所以x为正极,y为负极,
故答案为:正;
(2)A电极是阴极,该极上是氢离子放电,4H++4e-=2H2↑,若到此时,电路中共通过1.204×1024个e-,即转移电子是2mol,生成氢气1mol,体积是22.4L,
B电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑,电解的实质是电解水,所以氢氧化钾浓度增大,pH增大,
故答案为:4H++4e-=2H2↑;4OH--4e-=2H2O+O2↑;增大;22.4L;
(3)如果切断S2,闭合S1,则可由A中的H2,B中的O2与KOH溶液形成H2-O2燃料电池,把化学能变为电能,因此指针偏转,故答案为:偏转;
(4)在氢氧燃料电池中,负极氢气失去电子,正极氧气得到电子,所以氢气一极是负极,氧气一极是正极,电极反应式分别是:A极 2H2+4OH--4e-=4H2O、B极 2H2O+O2+4e-=4OH-.
故答案为:2H2O+O2+4e=4OH-.
故答案为:正;
(2)A电极是阴极,该极上是氢离子放电,4H++4e-=2H2↑,若到此时,电路中共通过1.204×1024个e-,即转移电子是2mol,生成氢气1mol,体积是22.4L,
B电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑,电解的实质是电解水,所以氢氧化钾浓度增大,pH增大,
故答案为:4H++4e-=2H2↑;4OH--4e-=2H2O+O2↑;增大;22.4L;
(3)如果切断S2,闭合S1,则可由A中的H2,B中的O2与KOH溶液形成H2-O2燃料电池,把化学能变为电能,因此指针偏转,故答案为:偏转;
(4)在氢氧燃料电池中,负极氢气失去电子,正极氧气得到电子,所以氢气一极是负极,氧气一极是正极,电极反应式分别是:A极 2H2+4OH--4e-=4H2O、B极 2H2O+O2+4e-=4OH-.
故答案为:2H2O+O2+4e=4OH-.
点评:该题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题.试题综合性强,难易适中,贴近高考,有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,提高学生学习效率.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某有机物A的结构为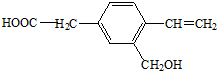 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A、分子式为C10H10O3,是一种芳香烃 |
| B、能发生加聚反应,也能发生酯化反应 |
| C、1 mol A能分别与1 mol金属钠、2mol NaOH反应 |
| D、A分子中所有原子可能在同一平面上 |
下列叙述正确的是( )
| A、pH=5的CH3COOH溶液和pH=5的NH4NO3溶液中,c(H+)相等 |
| B、常温下1L 0.1mol/L NH4Cl溶液与2L 0.05mol/L NH4Cl溶液中C(NH4+)相等 |
| C、pH=6的CH3COOH和CH3COONa混合液中:c(Na+)+c(OH-)-c(CH3COO-)=10-6mol/L |
| D、pH=9的NaHA溶液中:c(Na+)>c(HX-)>c(A2-)>c(H2A)>c(OH-)>c(H+) |
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: