题目内容
16.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.(1)该电池的负极材料是Zn.电池工作时,电子流向正极(填“正极”或“负极”).
(2)ZnCl2-NH4Cl混合溶液中含有杂质Cu2+外,会加速某电极的腐蚀,其主要原因是Zn+Cu2+=Zn2++Cu,锌和被置换出的铜形成原电池发生反应,锌做负极加快了锌的腐蚀.
(3)Mn是一种有重要用途的金属,工业上常通过铝热反应冶炼,写出MnO2与Al反应的化学方程式4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3.
(4)引发铝热反应的物质有少量KClO3和镁条.
分析 (1)活泼金属做原电池的负极,原电池中电子从负极经外电路流向电源的正极;
(2)锌比铜活泼,能置换出铜,在电解质溶液中形成原电池反应加速锌的腐蚀;
(3)MnO2与Al反应生成Mn和氧化铝;
(4)引发铝热反应是用铝热剂的上面加少量KClO3,中间插上镁条并将其点燃,由此分析解答.
解答 解:(1)Zn-MnO2干电池中,活泼金属锌做原电池的负极,工作时原电池中电子从负极经外电路流向电源的正极,故答案为:Zn,正极;
(2)锌比铜活泼,能置换出铜,反应为Zn+Cu2+=Zn2++Cu,形成原电池加速锌的腐蚀,
故答案为:Zn+Cu2+=Zn2++Cu,锌和被置换出的铜形成原电池发生反应,锌做负极加快了锌的腐蚀;
(3)MnO2与Al反应的化学方程式:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,
故答案为:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
(4)引发铝热反应的实验操作是在铝热剂的上面加少量KClO3,中间插上镁条并将其点燃,引发铝热反应的物质有少量KClO3和镁条,
故答案为:少量KClO3和镁条.
点评 本题考查原电池的工作原理、化学方程式的书写,注意反应的原理和方程式书写的规律,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
6.某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则( )

| A. | 电流方向:电极IV→电极I | |
| B. | 盐桥中的阳离子流向装 Al2(SO4)3池 | |
| C. | 电极 II 逐渐溶解 | |
| D. | 电极 III 的电极反应:Cu2++2e-=Cu |
7.一定质量的下列各组物质的混合物,不管两者以何种质量比混合,充分燃烧后所生成的H2O的质量都相等,该混合物可能是( )
| A. | 乙醇(C2H5OH)和乙烯 | B. | 丙烷和乙醛(CH3CHO) | ||
| C. | 乙烯和乙酸乙酯(CH3COOC2H5) | D. | 甲醛(HCHO)和葡萄糖(C6H12O6) |
4.下列叙述中,正确的是( )
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | NF3和BF3是中心原子杂化类型相同的极性分子 | |
| D. | 在SiO2晶体中,Si原子与Si-O键数目比为1:4 |
11.要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A. | 先加足量的KMnO4酸性溶液,然后再加入溴水 | |
| B. | 先加足量溴水,然后再加入KMnO4酸性溶液 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 加入浓硫酸与浓硝酸后加热 |
1.下列物质反应后的溶液中加入KSCN溶液一定会变红色的( )
| A. | Fe2O3与HCl反应 | B. | 过量铁粉与稀硝酸反应 | ||
| C. | 少量铁粉与稀盐酸作用 | D. | 铁粉与CuSO4反应 |
8.全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如表实验.
请回答:
①在一周的观察过程中,他发现实验序号为Ⅱ的试管中铁钉锈蚀速度最慢..
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 |  |  |  |
①在一周的观察过程中,他发现实验序号为Ⅱ的试管中铁钉锈蚀速度最慢..
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
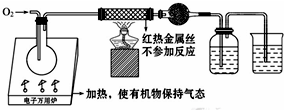 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.

 .
.