题目内容
11.将KCl和KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 3:1:1 |
分析 溶液中一定满足电荷守恒,原溶液中阳离子为钾离子,阴离子为氯离子和溴离子,则c(K+)=c(Br-)+c(Cl-),据此对各选项进行判断.
解答 解:将KCl和KBr混合物13.4g溶于水配成500mL溶液中,一定满足电荷守恒:c(K+)=c(Br-)+c(Cl-),选项中满足条件的只有A,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,根据电荷守恒得出c(K+)=c(Br-)+c(Cl-)为解答关键,试题侧重考查学生的分析能力及灵活应用.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
1.下列关于物质的分离,提纯实验中的一些操作或做法,其中正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 要除去乙烷中混有的乙烯气体可将混合气体通过盛有酸性高猛酸钾溶液的洗气瓶 | |
| D. | 用分液漏斗可以分离溴和CCl4、苯和水、乙酸和乙醇等液体混合物 |
19.一定温度下,有两个体积均为2L的恒容密闭容器I和Ⅱ,向I中加入1 mol CO和2 mol H2,向Ⅱ中加入2 mol CO和4 mol H2,均发生下列反应并建立平衡:CO(g)+2H2(g)?CH3OH(g).测得不同温度下CO平衡转化率如图所示.下列说法正确的是( )
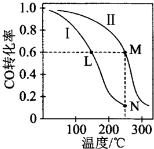

| A. | 该反应的△H>0 | |
| B. | N点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1 mol CH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4 mol |
6.向amol/L的氨水中加入等体积b mol•L-1的盐酸,下列关系错误的是( )
| A. | 当a=b时,c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 当a>b时,c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | 当a<b时,c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 当a与b为任意比时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
16.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
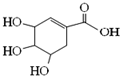

| A. | 分子式为C7H6O5 | |
| B. | 分子中的碳原子都在同一平面 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
3.常温下向25mL 0.1mol.L-1NaOH溶液中逐滴滴加0.2mol•L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
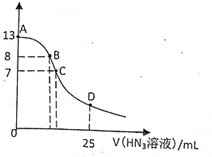

| A. | 水电离出的c(H+):A点小于B点 | |
| B. | 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5 mL | |
| D. | 在D点,c(Na+)=2c(HN3)+2 c(N3-) |
1.已知mg的H2S分子含有x个原子,则m g的NH3分子中所含的分子数为( )
| A. | x个 | B. | $\frac{x}{4}$个 | C. | $\frac{2x}{3}$个 | D. | $\frac{x}{2}$个 |
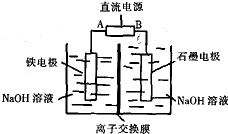 高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:
高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为: