题目内容
6.向amol/L的氨水中加入等体积b mol•L-1的盐酸,下列关系错误的是( )| A. | 当a=b时,c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 当a>b时,c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | 当a<b时,c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 当a与b为任意比时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
分析 A.当a=b时等浓度等体积混合得到氯化铵溶液,溶液中存在质子守恒,水电离出的氢离子和氢氧根离子浓度相同;
B.当a>b时等体积混合溶液中为一水合氨和氯化铵,依据物料守恒分析,氮元素所有存在形式之和比氯离子浓度大;
C.当a<b时,等体积混合溶液中为氯化铵和盐酸,溶液显酸性;
D.溶液中存在电荷守恒分析判断,阴阳离子所带电荷总数相同.
解答 解:A.当a=b时等浓度等体积混合得到氯化铵溶液,溶液中存在质子守恒,c(H+)=c(OH-)+c(NH3•H2O),故A正确;
B.当a>b时等体积混合溶液中为一水合氨和氯化铵,依据物料守恒分析,c(NH4+)+c(NH3•H2O)>c(Cl-),故B正确;
C.当a<b时,等体积混合溶液中为氯化铵和盐酸,溶液显酸性c(OH-)<c(H+),故C错误;
D.当a与b为任意比时溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),故D正确;
故选C.
点评 本题考查了酸碱反应后溶液中离子浓度大小比较,主要是电解质溶液中电荷守恒、物料守恒、质子守恒等知识的理解应用,题目难度中等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
16.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 上述现象说明[Cu(NH3)4]2+不如Cu(OH)2稳定 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
14.用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是( )
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定过程中不小心将液体从锥形瓶溅出 |
1.一定温度下,对可逆反应A(g)+2B(g)?3C(g)的下列叙述中,不能说明反应已达到平衡的是( )
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗a mol A,同时生成3a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体中B物质的量不再变化 |
11.将KCl和KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 3:1:1 |
18. 实验室以2一丁醇(
实验室以2一丁醇( )为原料制备2-氯丁烷
)为原料制备2-氯丁烷
( ),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:
),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:
以下是实验步骤:
步骤1:在圆底烧瓶内放入无水ZnC12和12mol.L一1浓盐酸,充分溶解、冷却,再加入2一丁
醇,加热一段时间.
步骤2:将反应混合物移至蒸馏装置内,蒸馏并收集115℃以下馏分.
步骤3:从馏分中分离出有机相,依次用蒸馏水、5%NaoH溶液、蒸馏水
洗涤,再加入CaCl2固体,放置一段时间后过滤.
步骤4:滤液经进一步精制得产品
(1)加入烧瓶的物质中,有一种是催化剂,该物质是无水ZnCl2.
(2)反应装置中冷凝管的作用是冷凝回流提高原料利用率,烧杯内所盛液体可以是水或碱液.
(3)用NaoH溶液洗涤时操作要迅速,其原因是防止2-氯丁烷水解减少2-氯丁烷挥发,第二次用蒸馏水
洗涤的目的是除去残留的氢氧化钠.
(4)步骤4精制过程中不需使用的仪器是ad.
a.布氏漏斗b.抽滤瓶c.蒸馏烧瓶d.冷凝管.
 实验室以2一丁醇(
实验室以2一丁醇( )为原料制备2-氯丁烷
)为原料制备2-氯丁烷(
 ),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:
),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:| 物质 | 熔点 (℃) | 沸点(℃) |
| 2-丁醇 | -114.7 | 99.5 |
| 2-氯乙烷 | -131.3 | 68.2 |
步骤1:在圆底烧瓶内放入无水ZnC12和12mol.L一1浓盐酸,充分溶解、冷却,再加入2一丁
醇,加热一段时间.
步骤2:将反应混合物移至蒸馏装置内,蒸馏并收集115℃以下馏分.
步骤3:从馏分中分离出有机相,依次用蒸馏水、5%NaoH溶液、蒸馏水
洗涤,再加入CaCl2固体,放置一段时间后过滤.
步骤4:滤液经进一步精制得产品
(1)加入烧瓶的物质中,有一种是催化剂,该物质是无水ZnCl2.
(2)反应装置中冷凝管的作用是冷凝回流提高原料利用率,烧杯内所盛液体可以是水或碱液.
(3)用NaoH溶液洗涤时操作要迅速,其原因是防止2-氯丁烷水解减少2-氯丁烷挥发,第二次用蒸馏水
洗涤的目的是除去残留的氢氧化钠.
(4)步骤4精制过程中不需使用的仪器是ad.
a.布氏漏斗b.抽滤瓶c.蒸馏烧瓶d.冷凝管.
15.下列方程式正确的是( )
| A. | 用氯胺处理自来水:NH2Cl+H2O?NH2OH+HCl | |
| B. | 在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水:Ca2++Mg2++2OH-+2HCO3-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 长时间煮沸含Mg2+、HCO3-的自来水:Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑ | |
| D. | Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为:Fe3++3H2O═Fe(OH)3(胶体)+3H+ |
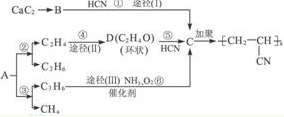 人造羊毛的主要成分为聚丙烯腈
人造羊毛的主要成分为聚丙烯腈 ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.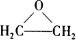 .
.