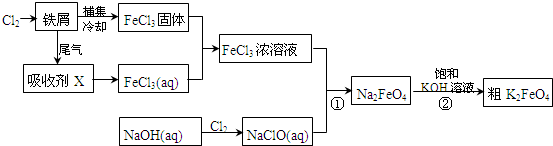
题目内容
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、电解精炼铜时,每转移2mol电子阳极上溶解的铜原子数为NA |
| B、1.4g的聚乙烯中约含有0.1NA碳原子 |
| C、14gCnH2n中含有的共用电子对数为NA |
| D、标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
考点:阿伏加德罗常数
专题:
分析:A、电解精炼铜时,比铜活泼的金属先溶解;
B、只需计算1.4gCH2中碳的物质的量即可;
C、根据原子最外层电子数计算每个CnH2n分子中含有共用电子对数为
=3n对,根据n=
计算14gCnH2n的物质的量,再根据N=nNA计算共用电子对数.
D、标况下,溴乙烷是液态.
B、只需计算1.4gCH2中碳的物质的量即可;
C、根据原子最外层电子数计算每个CnH2n分子中含有共用电子对数为
| 4×n+2n |
| 2 |
| m |
| M |
D、标况下,溴乙烷是液态.
解答:
解:A、电解法精炼铜时,粗铜作阳极,发生的反应有:Zn-2e-=Zn2+,Fe-2e-=Fe2+,Ni-2e-=Ni2+,Cu-2e-=Cu2+,可见每转移2mol电子时阳极上溶解的铜必小于NA,故A错误;
B、1.4g聚乙烯含有的碳原子数目只需计算14gCH2中碳的物质的量即可,
=0.1mol,碳原子数为0.1NA,故B正确;
C、14gCnH2n的物质的量为
=
mol,每个CnH2n分子中含有共用电子对为3n对,所以,14gCnH2n中含有的共用电子对数为3NA,故C错误;
D、标况下,溴乙烷是液态,故D错误.
故选B.
B、1.4g聚乙烯含有的碳原子数目只需计算14gCH2中碳的物质的量即可,
| 1.4g |
| 14g/mol |
C、14gCnH2n的物质的量为
| 14g |
| 14ng/mol |
| 1 |
| n |
D、标况下,溴乙烷是液态,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各选项所述的两个量,前者一定大于后者的是( )
| A、纯水在25℃和80℃时pH |
| B、25℃时,等体积的pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数 |
| C、25℃时,浓度均为0.1mol/L的FeCl3溶液和NH4Fe(SO4)2溶液中的c(Fe3+) |
| D、25℃时,中和体积与pH都相同的氢氧化钠溶液和氨水所消耗HCl的物质的量 |
下列变化中,需加氧化剂才能实现的是( )
| A、NaClO→NaCl |
| B、C→CO2 |
| C、Fe2O3→Fe |
| D、CaO→Ca(OH)2 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、标况下,11.2L SO3所含的分子数目为0.5 NA |
| B、室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA |
| C、铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA |
| D、8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量-27) |
下列离子方程式正确的是( )
| A、铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ |
| B、向Na2CO3饱和溶液中通入过量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ |
| C、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O |
| D、向偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |

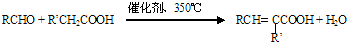
 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是