题目内容
15.常温下,下列有关溶液pH的相关说法正确的是( )| A. | 将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13 mol•L-1 | |
| B. | 将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11 | |
| C. | 将pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7 | |
| D. | 将pH=1的硫酸和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3 |
分析 A.根据稀释后溶液中氢氧根离子浓度计算氢离子浓度;
B.氢氧化钠和氢氧化钡都是强电解质,所以两种溶液等体积混合时,氢氧根离子浓度等于二者氢氧根离子浓度的一半,再根据离子积常数计算氢离子浓度;
C.氢氧化钡和氯化氢都是强电解质,二者等体积混合时发生中和反应,根据氢离子和氢氧根离子的物质的量相对大小确定溶液的酸碱性;
D.氯化氢和硫酸都是强电解质,两种溶液等体积混合时,离子浓度等于二者氢离子浓度的一半.
解答 解:A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中氢氧根离子浓度是10-5 mol/L,则c(H+)=10-9mol/L,故A错误;
B.氢氧化钠和氢氧化钡都是强电解质,所以两种溶液等体积混合时,氢氧根离子浓度等于二者氢氧根离子浓度的一半,即混合溶液中氢氧根离子浓度=$\frac{1}{2}$(10-5+10-1)mol/L≈0.05,所以氢离子浓度2×10-11mol/L,则溶液的pH小于11,故B错误;
C.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,氢离子和氢氧根离子的物质的量相等,所以氢离子和氢氧根离子恰好反应,溶液呈中性,故C错误;
D.氯化氢和硫酸都是强电解质,两种溶液等体积混合时,离子浓度等于二者氢离子浓度的一半,即混合溶液的氢离子浓度约等于0.05mol/L,则混合溶液的pH=1.3,故D正确;
故选D.
点评 本题考查了混合溶液pH的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,注意两种溶液混合时离子浓度的变化,为易错点.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
5.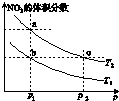 在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
 在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点的反应速率:a>c | B. | 由a点到b点,可以用加热的方法 | ||
| C. | a、c两点气体的颜色:a深,c浅 | D. | a、b两点NO2的转化率:a<b |
10.下列物质既有氧化性又有还原性的是( )
| A. | Fe | B. | SO2 | C. | KMnO4 | D. | 浓 H2SO4 |
20.标况下将448L氯化氢溶于1L水(纯水的密度为1.0g/cm3),所得溶液密度1.1g/cm3,溶液中氯化氢的浓度为( )
| A. | 11.7mol/L | B. | 12.7mol/L | C. | 13.7mol/L | D. | 14.7mol/L |
4.使用绿色能源有利于保护环境.下列能源中不属于绿色能源的是( )
| A. | 氢能 | B. | 化石能 | C. | 风能 | D. | 太阳能 |