题目内容
1.设NA为阿伏加德罗常数,下列说法中正确的是( )| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
分析 A、标准状况下,密度为dg/L的某气体纯净物摩尔质量=22.4dg/mol;
B、求出甲基的物质的量,然后根据1mol甲基(-14CH3)中含8mol中子来分析;
C、pH=13的氢氧化钠溶液中,氢氧根的浓度为0.1mol/L;
D、求出钠的物质的量,然后根据钠反应后变为+1价来分析.
解答 解:A、标准状况下,密度为dg/L的某气体纯净物摩尔质量为22.4dg/mol,一个分子的质量为$\frac{22.4d}{{N}_{A}}$g,故A正确;
B、17g甲基的物质的量为1mol,而1mol甲基(-14CH3)中含8mol中子,故含8NA个,故B错误;
C、pH=13的氢氧化钠溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中含氢氧根的物质的量为n=CV=0.1mol/L×1L=0.1mol,个数为0.1NA个,故C错误;
D、4.6g钠的物质的量为0.2mol,而钠反应后变为+1价,故0.2mol钠反应后转移0.2NA个电子,故D正确.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.将一定质量的纯碱溶于水中,与适量的盐酸作用,若纯碱中混有KHCO3,从下列关于盐酸的用量和生成CO2气体的量的分析正确的是( )
| A. | 盐酸用量偏大,生成CO2气体的量偏大 | |
| B. | 盐酸用量偏大,生成CO2气体的量偏小 | |
| C. | 盐酸用量偏小,生成CO2气体的量偏大 | |
| D. | 盐酸用量偏小,生成CO2气体的量偏小 |
9. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表,V1=20mL.
①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请完成假设2和假设3:
假设1:Fe2+起催化作用;
假设2:Al3+起催化作用;
假设3:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表,V1=20mL.
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请完成假设2和假设3:
假设1:Fe2+起催化作用;
假设2:Al3+起催化作用;
假设3:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
16.某厂平均每天产生约600m3废氨水(NH3 的浓度为153mg•L-1,密度为1g•cm-3.
(1)该废氨水中氨的物质的量浓度为9×10-3 mol•L-1.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为89%.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
试计算生成氨气的质量最大时样品的质量.
(1)该废氨水中氨的物质的量浓度为9×10-3 mol•L-1.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为89%.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
6.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物( )
| A. | 透明陶瓷材料硒化锌 | B. | 半导体材料砷化镓 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
13.一般情况下,前者无法决定后者的是( )
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 可逆反应向正方向进行的程度--电离常数的大小 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
10.下列关于有机物的同分异构体的说法中,不正确的是(不考虑立体异构)( )
| A. | 分子式为C3H6Cl2的同分异构体有3种 | |
| B. | 分子式为C5H12O,且能与金属钠反应的同分异构体有8种 | |
| C. | 分子式为C4H8O2属于羧酸类的同分异构体有2种 | |
| D. | 分子式为C4H8O2属于酯类的同分异构体有4种 |
11.下列说法正确的是( )
| A. | CaCO3是共价化合物 | |
| B. | 羟基既含有共价键又含有离子键 | |
| C. | O2分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | SO2是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
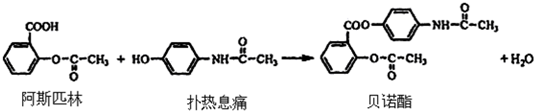
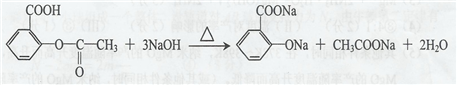 .
. .
.