题目内容
 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )| A、反应开始到2min,用A表示的反应速率为0.1 mol?Lˉ1?minˉ1 |
| B、反应开始到2min,B的物质的量浓度增加了0.2mol/L |
| C、反应进行到2min时,该反应停止了 |
| D、反应的化学方程式为:2A(g)?2B(g)+C(g) |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:根据图象知,随着反应的进行,A的物质的量减小,B、C的物质的量增加,说明A是反应物,B、C是生成物,达到平衡时△c(A)=(0.4-0.2)mol/L=0.2mol/L,△c(B)=(0.3-0.1)molmol/L=0.2mol/L,△c(C)=(0.1-0)molmolmol/L=0.2mol/L,同一反应中同一时间段内各物质的物质的量浓度变化之比等于其计量数之比,所以A、B、C的计量数之比=2:2:1,则该反应方程式为2A(g)?2B(g)+C(g),据此分析.
解答:
解:根据图象知,随着反应的进行,A的物质的量减小,B、C的物质的量增加,说明A是反应物,B、C是生成物,达到平衡时△c(A)=(0.4-0.2)mol/L=0.2mol/L,△c(B)=(0.3-0.1)molmol/L=0.2mol/L,△c(C)=(0.1-0)molmolmol/L=0.2mol/L,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,所以A、B、C的计量数之比=2:2:1,则该反应方程式为2A(g)?2B(g)+C(g),
A.反应开始到2min,用A表示的反应速率为=
=0.1 mol?Lˉ1?minˉ1,故A正确;
B.反应开始到2min,B的物质的量浓度增加了0.2mol/L,故B正确;
C.反应进行到2min时,达到平衡,反应没有停止,故C错误;
D.通过以上分析知,该反应方程式为2A(g)?2B(g)+C(g),故D正确;
故选ABD.
A.反应开始到2min,用A表示的反应速率为=
| 0.2mol/L |
| 2min |
B.反应开始到2min,B的物质的量浓度增加了0.2mol/L,故B正确;
C.反应进行到2min时,达到平衡,反应没有停止,故C错误;
D.通过以上分析知,该反应方程式为2A(g)?2B(g)+C(g),故D正确;
故选ABD.
点评:本题考查图象分析,涉及方程式的确定、物质的量及物质的量浓度和反应速率的计算,熟练掌握基本公式及方程式中物质的量变化量与计量数的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学与人类生活、社会可持续发展密切相关.下列有关说法不正确的是( )
| A、开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
| B、高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有危害 |
| C、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
| D、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O,故对环境不造成污染 |
将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2
2NH3 下列关于该反应的说法中正确的是( )
| 高温高压 |
| 催化剂 |
| A、增大压强,反应速率减小 |
| B、最终可生成0.2 mol NH3 |
| C、升髙温度,反应速率增大 |
| D、当v正(N2):v正(H2)=1:3时,一定达化学平衡 |
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量为△H1;等量的氢气在同样条件下完全燃烧生成液态水,放出热量为△H2;△H1与△H2的关系为( )
| A、△H1<△H2 |
| B、△H1=△H2 |
| C、△H1>△H2 |
| D、无法确定 |
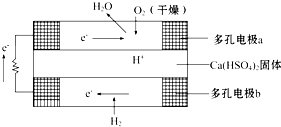 如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )| A、H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B、a极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D、H+由b极通过固体酸电解质传递到a极 |
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
| A、元素A所形成的氧化物只有一种 |
| B、元素B的最高价氧化物对应的水化物为强酸 |
| C、元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应 |
| D、氢化物的稳定性:A>B |