题目内容
2.有五瓶失去标签的溶液,它们分别是:①Ba(NO3)2②KCl③KOH④CuSO4⑤Na2SO4.如不用其它任何试剂(包括试纸),用最简单的方法将它们一一鉴别开来.则下列顺序合理的是④①③⑤②或④③①⑤②.分析 根据铜离子在溶液中显蓝色,铜离子和氢氧根离子会生成蓝色沉淀,钡离子和硫酸根离子会生成白色沉淀,氯化钾不会出现现象最后鉴别等,然后再结合题中给出的顺序进行合理分析.
解答 解:铜离子在溶液中显蓝色,首先观察溶液的颜色,可以确定显蓝色的是④硫酸铜,然后将硫酸铜滴入剩余的四种溶液中,一种会出现蓝色沉淀,是③氢氧化钾,另一种会出现白色沉淀,是①硝酸钡;然后将硝酸钡滴入剩余的两种溶液中出现白色沉淀的是⑤硫酸钠,没有现象的是②氯化钾,④硫酸铜应该在第一个,③氢氧化钾、①硝酸钡的顺序可以颠倒,硫酸铜不会鉴别出硫酸钠,硫酸钠需要用前面鉴别出的硝酸钡鉴别,②氯化钾应该放在最后,综合考虑,鉴别出的先后顺序是:④①③⑤②或④③①⑤②.
点评 在解此类题时,先要根据所给的溶液的颜色鉴别出带色的溶液,然后再用该试剂鉴别其他的物质,再用鉴别出来的物质鉴别其他的物质,依此类推.

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | S-H…O | B. | N-H…N | C. | F-H…F | D. | C-H…N |
利用如图装置测定中和热的实验步骤如下:

①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)如右图所示,仪器A的名称是_______________;
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃[ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则C H3COOH在水溶液中电离的ΔH等于_________
H3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1
C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2 Fe2+ | |
| D. | NaHCO3溶液与盐酸反应:HCO3-+H+=CO2↑+H2O |
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 某溶液中滴加盐酸能产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含CO32- | |
| D. | 向某溶液中加入BaCl2溶液出现白色沉淀,再加入HCl溶液,白色沉淀不溶解,则该溶液中肯定有SO42- |
| A. | $\frac{18}{{N}_{A}}$ | B. | $\frac{18}{{N}_{A}}$g•mol-1 | C. | 18NA g | D. | $\frac{18}{{N}_{A}}$g |
 增大。
增大。
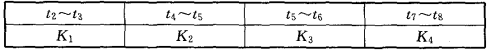
 反应是 ( )
反应是 ( )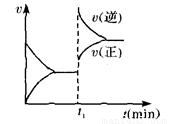
 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0