题目内容
15.已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系.下列说法错误的是( )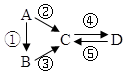
| A. | 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染.则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO | |
| B. | 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化.在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H1、△H 2、△H 3,则它们之间的关系为△H 2=△H1+△H 3 | |
| C. | 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑ | |
| D. | 若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸 |
分析 A.若A是大气中含量最多的气体,应为氮气,C、D是氧化物且会造成光化学污染,由转化关系可知B为NH3,C为NO,D为NO2;
B.反应的能量变化遵循盖斯定律;
C.若C为一元强碱且阴、阳离子所含的电子数相同,应为NaOH,D为日常生活中常用的调味品,应为NaCl;
D.A是应用最广泛的金属,应为Fe,C和D为Fe3+和Fe2+之间的转化.
解答 解:A.若A是大气中含量最多的气体,应为氮气,C、D是氧化物且会造成光化学污染,由转化关系可知B为NH3,C为NO,D为NO2,则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO,故A正确;
B.反应的能量变化遵循盖斯定律,由反应关系可知△H 2=△H1+△H 3,故B正确;
C.若C为一元强碱且阴、阳离子所含的电子数相同,应为NaOH,D为日常生活中常用的调味品,应为NaCl,工业上用D制备A,用电解的方法,电解方程式为2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,故C错误;
D.A是应用最广泛的金属,应为Fe,C和D为Fe3+和Fe2+之间的转化,实验室保存氯化亚铁,应防止氧化而变质以及水解,可加入适量铁粉与适量盐酸,故D正确.
故选C.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物性质,较好考查学生综合应用知识的能力,题目综合性较强,难度中等.

练习册系列答案
相关题目
5.下列关于Cl2的叙述中,正确的是( )
| A. | Cl2的摩尔质量是71g | |
| B. | 1molCl2中所含分子数约为6.02×1023 | |
| C. | 1molCl2的质量是71g•mol-1 | |
| D. | 常温常压下,1molCl2的体积为22.4L |
3.下列说法正确的是( )
| A. | 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 铝热剂、福尔马林、水玻璃、漂白粉均为混合物 | |
| C. | 一定条件下,1mol苯甲醛最多能与3molH2反应 | |
| D. | 乙醇、乙酸均能与NaOH稀溶液反应,因为分子中均含有官能团“-OH” |
10.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
20.在FeCl3和CuCl2的混合溶液中投入Fe,充分反应后,溶液中所含阳离子不可能出现的情况是(不考虑水电离出的H+)( )
| A. | 只含Fe2+ | B. | 只含Cu2+、Fe2+ | ||
| C. | 只含Fe3+、Fe2+ | D. | 只含Fe3+、Cu2+、Fe2+ |
7.图为实验室制取少量乙酸乙酯的装置图.下列叙述不正确的是( )
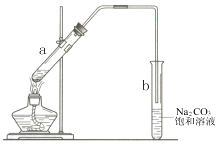

| A. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
12.下列溶液配制实验的描述完全正确的是( )
| A. | 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 | |
| B. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol•L-1)通常需要用容量瓶等仪器 | |
| C. | 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解 | |
| D. | 用pH=1的盐酸配制100 mL pH=2的盐酸所需全部玻璃仪器有100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
13.下列溶液可用无色试剂瓶装的是( )
| A. | 浓HNO3 | B. | AgNO3 | C. | 氯水 | D. | 浓H2SO4 |