题目内容
18.马来酸酐在有机合成、医学及食品工业中用途非常广泛,其制备方法如下: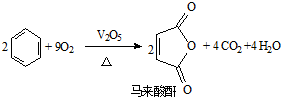
(1)V基态原子核外电子排布式为[Ar]3d34s2或1s22s22p63s23p63d34s2
(2)马来酸酐分子中C原子杂化轨道类型为sp21mol马来酸酐分子中含有σ键的数目为9mol.
(3)与CO2互为等电子体的阴离子为N3-、OCN-或SCN-等(举1例).
(4)一种钒的配合物分子结构如图1所示,该配合物中钒元素的化合价为+3
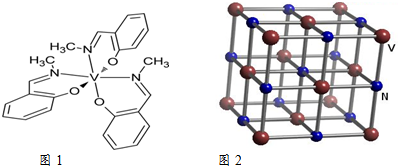
(5)钒的一种氮化物晶胞结构如图2所示,晶胞中钒原子的配位数为6.
分析 (1)V的原子序数为23号,按构造原理写出核外电子排布式;
(2)从马来酸酐分子结构中可知C原子与其他原子形成3条σ键,不存在孤对电子,杂化轨道类型为sp2;1个马来酸酐分子中C与C之间有3条σ键,C与O之间有4条σ键,C与H之间有2条σ键,共9条;
(3)价电子数相等、原子个数相等的微粒为等电子体;
(4)从分子结构中可得出1个N和1个O各提供1个电子形成1对共用电子对,这样的共用电子对有3对,V提供3个空轨道,3对电子偏离V,使得V的化合价为+3价;
(5)以面心上的V来看,与V等距的N在同一个面上就有4个,体内有1个,与这个晶胞重叠的晶胞体内还有这样的氮原子1个,共6个.
解答 解:(1)V的原子序数为23号,核外电子排布式为:[Ar]3d34s2 或1s22s22p63s23p63d34s2,
故答案为:[Ar]3d34s2 或1s22s22p63s23p63d34s2;
(2)从马来酸酐分子结构中可知C原子与其他原子形成3条σ键,不存在孤对电子,杂化轨道类型为sp2;1个马来酸酐分子中C与C之间有3条σ键,C与O之间有4条σ键,C与H之间有2条σ键,共9条,则1mol马来酸酐分子中含有σ键的物质的量为9mol,
故答案为:9;
(3)CO2价电子数为16,原子个数为3,价电子数相等、原子个数相等的微粒为等电子体,则与CO2互为等电子体的阴离子为:N3-、OCN-或SCN-等,
故答案为:N3-、OCN-或SCN-等;
(4)从分子结构中可得出1个N和1个O各提供1个电子形成1对共用电子对,这样的共用电子对有3对,V提供3个空轨道,3对电子偏离V,使得V的化合价为+3价,
故答案为:+3;
(5)以面心上的V来看,与V等距的N在同一个面上就有4个,体内有1个,与这个晶胞重叠的晶胞体内还有这样的氮原子1个,共6个,
故答案为:6.
点评 本题考查了核外电子排布、杂化方式、等电子体及配位化合物中化合价、配位数等知识,其中第(4)题难度较大.

| A. | CaO+H2O═Ca(OH)2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | Cl2+H2O═HCl+HClO |
| A. | O、F、H的原子半径依次减小 | |
| B. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| C. | 干冰、钠、冰的熔点依次降低 | |
| D. | 金属Na、Mg、Al的硬度依次降低 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:C2H5OH | ||
| C. | 乙酸的实验式:CH2O | D. | 苯的结构式: |
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO2,SO2排放到空气中都能形成酸雨,应严格控制排放 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| A. | 1:5 | B. | 3:1 | C. | 5:1 | D. | 7:1 |
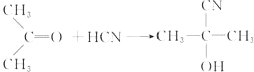
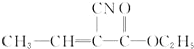 ,写出各步反应的化学方程式
,写出各步反应的化学方程式 .
.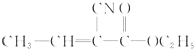 被涂在手术伤口表面,在数秒内发生固化(加聚)并起黏结作用以代替缝合,是一种性能优良的功能高分子材料,写出该化合物固化时的化学反应方程式
被涂在手术伤口表面,在数秒内发生固化(加聚)并起黏结作用以代替缝合,是一种性能优良的功能高分子材料,写出该化合物固化时的化学反应方程式 .
.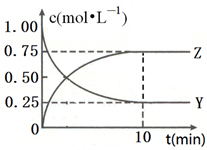 已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: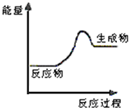 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑