题目内容
10.一未完成的离子方程式( )+XO${\;}_{3}^{-}$+6H+═( )3X2+3H2O,据此判断,氧化产物和还产物的物质的量之比为( )| A. | 1:5 | B. | 3:1 | C. | 5:1 | D. | 7:1 |
分析 由质量守恒和电荷守恒可得出该离子反应方程式为5X-+XO3-+6H+═3X2+3H2O,元素化合价升高得到产物为氧化产物,元素化合价降低得到的产物为还原产物,结合想方程式判断.
解答 解:由质量守恒和电荷守恒可得出该离子反应方程式为5X-+XO3-+6H+═3X2+3H2O,X-为还原剂,得到氧化产物,XO3-为氧化剂,生成还原产物,根据X原子守恒可知,氧化产物和还原产物的物质的量之比为5:1,
故选C.
点评 本题考查氧化还原反应基本概念与计算,难度不大,关键是由质量守恒和电荷守恒确定离子反应方程式.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
20.一定温度下,W g下列物质在足量氧气中充分燃烧,产物与过量的Na2O2完全反应,Na2O2固体增重W g,符合此要求的组合是( )
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
| A. | 只有① | B. | 只有①②③ | C. | 只有①②③④ | D. | 都可以 |
15.向2.2克某饱和一元醛中加入足量银氨溶液,在一定条件下充分反应后析出10.8克银,该醛是( )
| A. | CH3CH2CH2CHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH(CH3)CHO |
2.2013年8月6日,中欧光伏产业谈判协议正式生效,为我国乃至世界新能源的发展起到极大的推动作用,晶体硅是光伏产业的重要材料.下列说法正确的是( )
| A. | 硅不能作为新能源开发的材料 | B. | 硅不可能与同主族的碳形成化合物 | ||
| C. | 二氧化硅属于离子化合物 | D. | 获取新能源不一定要发生化学变化 |
3. 维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
 维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )| A. | 维生素C由于含有C═O键而能发生银镜反应 | |
| B. | 维生素C由于含有酯基而难溶于水 | |
| C. | 维生素C的分子式为C6H8O6 | |
| D. | 维生素C的酸性可能是①、②两个羟基引起的 |
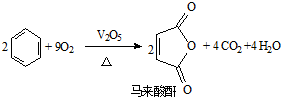
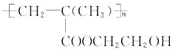 ,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式: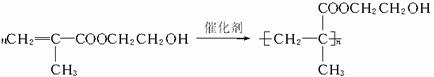 .
.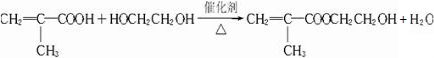 .
. .
.

 ,青蒿素分子式为C15H22O5.
,青蒿素分子式为C15H22O5.