题目内容
11. 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑B.Zn+H2SO4═ZnSO4+H2↑
C.C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO
D.2KOH+H2SO4═K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合图的是C(填反应序号).
(2)2SO2(g)+O2(g)?2SO3(g)该反应属于放热(吸热或放热)反应,当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q,则Q<197KJ(<,>,=).加快该反应速率的方法为使用催化剂(填一种即可)
(3)在常温下,上述四个反应中可用于设计原电池的是B(填反应序号).根据该原电池回答下列问题:
①负极材料是锌,负极发生氧化(填“氧化”或“还原”)反应;正极反应式为2H++2e-=H2↑,电解质溶液中的SO42-向负极移动.
②当导线中有1mol电子通过时,理论上发生的变化是bc(填序号).
a.溶液增重32.5g b.溶液增重31.5g
c.析出1g H2 d.析出11.2LH2
(4)实验室用铅蓄电池做电源电解饱和食盐水制取氯气,电解饱和食盐水制取氯气方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,已知铅蓄电池放电时的反应方程式为Pb+PbO2+2H2SO4→2PbSO4+2H2O,若电池参加反应硫酸的物质的量为0.20mol,则在标准状况下,产生氯气的体积为2.24L.
分析 (1)图1为生成物能量大于反应物能量,则该反应为吸热反应,根据是否有化合价变化判断是否为氧化还原反应;
(2)2SO2(g)+O2(g)?2SO3(g)该反应属于放热反应,可逆反应不可能完全转化,所以向密闭容器中通入2molSO2和1molO2,放出热量小于197KJ,可通过使用催化剂,增大压强,升高温度的方法来加快反应速率;
(3)能设计成原电池的反应通常是放热反应,依据原电池原理可知必须是氧化还原反应;
①发生氧化反应的为负极,发生还原反应的为正极;
②依据电子转移守恒计算和分析两个电极变化;
(4)电解饱和食盐水反应生成NaOH、H2、Cl2,反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,根据蓄电池的电极反应得电池反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,根据串联电路中转移电子的物质的量相等进行计算.
解答 解:(1)由图1为生成物能量大于反应物能量,则该反应为吸热反应,有化合价变化的是为氧化还原反应,则只有C为吸热的氧化还原反应,故选:C;
(2)2SO2(g)+O2(g)?2SO3(g)该反应属于放热反应,可逆反应不可能完全转化,所以向密闭容器中通入2molSO2和1molO2,放出热量小于197KJ,可通过使用催化剂,增大压强,升高温度的方法来加快反应速率,故答案为:放热;<;使用催化剂;
(3)设计原电池需要反应发生的是氧化还原反应,原电池的反应通常是放热反应,比较分析可知AD为非氧化还原反应,B为放热反应的氧化还原反应,C为吸热反应的氧化还原反应,所以B符合原电池设计原理的要求,故答案为:B;
①由原电池总反应Zn+H2SO4═ZnSO4+H2↑,其中负极材料是锌,发生氧化反应,溶液中氢离子得到电子在正极生成氢气,电极反应2H++2e-=H2↑,原电池中阴离子向负极移动,故答案为:锌;氧化;2H++2e-=H2↑;负;
②当导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;正极上放出氢气,根据电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,所以选项中bc正确;
故答案为:bc;
(4)电解饱和食盐水反应生成NaOH、H2、Cl2,该反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,根据PbO2+Pb+2H2SO4═2PbSO4+2H2O知,电池参加反应硫酸的物质的量为0.20mol,则转移电子的物质的量为0.2mol,产生氯气的物质的量为0.1mol,所以体积为2.24L,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;2.24L.
点评 本题考查了原电池的设计、原理的分析和应用,主要是电极反应及其相关计算,电极产物判断,掌握基础是关键,题目难度中等.

| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHCO3溶液与NaOH反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| D. | 向氢氧化钡溶液中通入少量二氧化硫气体:2OH-+SO2═SO32-+H2O |
 维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )| A. | 维生素C由于含有C═O键而能发生银镜反应 | |
| B. | 维生素C由于含有酯基而难溶于水 | |
| C. | 维生素C的分子式为C6H8O6 | |
| D. | 维生素C的酸性可能是①、②两个羟基引起的 |
 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )| A. | 消耗22.4 LCO2可制得1mol乙酸 | |
| B. | 该反应过程符合“绿色化学”原理,其原子利用率为100% | |
| C. | 该反应属于取代反应 | |
| D. | 反应物和生成物中均含有极性键和非极性键 |
| 选项 | 类别 | 物质 |
| A | 碱性氧化物 | Na2O2 Al2O3 MgO |
| B | 酸式盐 | NaHCO3 NaHSO4 NH4Cl |
| C | 弱酸 | H2S H2SO4 CH3COOH |
| D | 强电解质 | AgCl MgSO4 CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
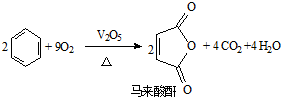


 ,青蒿素分子式为C15H22O5.
,青蒿素分子式为C15H22O5.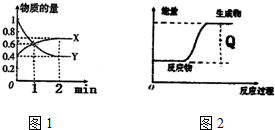
 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).