题目内容
8.利用天然气合成氨的工艺流程示意如下: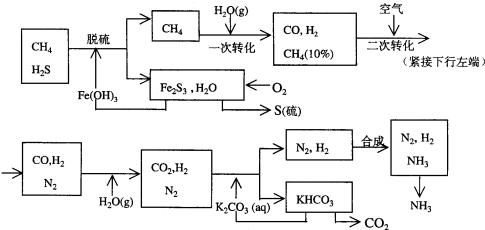
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)若n mol CH4经一次转化后产生CO 0.9n mol、产生H22.7nmol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是b(多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺的主要原料是CH4、H2O(g)和空气,辅助原料是K2CO3和Fe(OH)3.
(5)请写出以CH4为基本原料四次转化为合成氨工艺主要原料N2、H2的化学方程式:
CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+3H2、2CH4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO+4H2O、CO+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2+H2、CO2+H2O+K2CO3$\frac{\underline{\;高温\;}}{\;}$2KHCO3;.
(6)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中找出第三处循环并写在答题卡上(要求:循环方向、循环物质).
分析 (1)硫化氢是酸性气体,可以和碱发生中和反应生成盐和水;
(2)计算出甲烷的物质的量,根据方程式计算氢气的物质的量;
(3)根据化学平衡移动原理来回答;
(4)利用氢气合成氨的工艺流程知道:起始原料是CH4、H2O、空气,而辅助原料是K2CO3、Fe(OH)3;
(5)根据流程图书写,具体解答;
(6)根据合成氨的原理可以推知循环使用的是氮气和氢气.
解答 解:(1)硫化氢是酸性气体,可以和碱氢氧化铁发生中和反应:3H2S+2Fe(OH)3═Fe2S3+6H2O,
故答案为:3H2S+2Fe(OH)3═Fe2S3+6H2O;
(2)根据天然气合成氨的工艺流程图知10%的甲烷未与水蒸汽作用,甲烷与水反应的方程式为:
CH4(g)+H2O(g)→CO(g)+3H2(g)
1 3
0.9n mol 2.7nmol
故答案为:2.7n;
(3)K2CO3(aq)和CO2反应生成碳酸氢钾,K2CO3+CO2+H2O?2KHCO3,增大压强,化学平衡向右进行,符合化学平衡移动原理,故答案为:b;
(4)根据流程图可知,该合成氨工艺主要起始原料是CH4、H2O、空气,而辅助原料是K2CO3、Fe(OH)3,故答案为:CH4、H2O、空气;K2CO3;Fe(OH)3;
(5)根据流程图可知,以CH4为基本原料四次转化为合成氨工艺主要原料N2、H2的化学方程式见下,答案为:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO+3H2、2CH4+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO+4H2O、CO+H2O(g) $\frac{\underline{\;高温\;}}{\;}$CO2+H2、CO2+H2O+K2CO3 $\frac{\underline{\;高温\;}}{\;}$2KHCO3;
(6)上述流程图第三处循环使用的物质是氮气和氢气,故答案为: .
.
点评 本题考查了天然气合成氨的有关知识,重点掌握相关物质的化学性质,考查了分析和解决问题的能力,难度较大.

| A. | b>c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
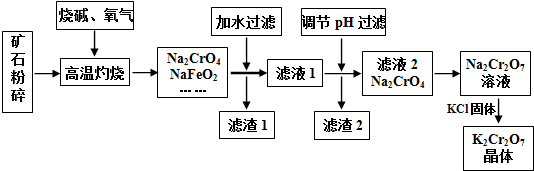
已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
| W | X | Y |
| Z |
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | X与Y形成的气态化合物超过两种 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
| A. | 镁元素基态原子的核外电子排布式是:1s22s22p63s2 | |
| B. | 铝元素原子核外共有5种不同运动状态的电子 | |
| C. | 钠元素离子半径比铝离子半径大 | |
| D. | 金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ |