题目内容
13.H2和O2的混合气体,在120℃和一定压强下体积为a L,点燃后发生应.待气体恢复至原来温度和压强时,测得其体积为bL.(1)若剩余气体含H2,a L气体中含H2bL.
(2)若剩余气体含O2,a L气体中含H22(a-b)L.
分析 根据题意可以知道,同温、同压下,相同体积的不同气体分子中含有相同数目分子,所以结合氢气和氧气反应的化学方程式可以知道反应中氢气和氧气反应的体积之比为2:1,由于没有指明各物质的体积关系,所以在反应时有三种情况:①恰好完全反应,②氧气剩余,③氢气剩余,所以可以据此结合化学方程式来完成解答.
解答 解:氢气和氧气反应的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,在120℃和1.01×105Pa压强下,生成的水也是以气体的状态存在的,
(1)若氢气过量,则设氧气的体积为y,则:
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
2 1 2
2y y 2y
根据反应前后剩余的氢气的质量相等得:
aL-(2y+y)=bL-2y
解得:y=(a-b)L
即原混合气体中氧气的体积为(a-b)L,氢气=aL-(a-b)L=bL,故答案为:b;
(2)如果氧气过量,则设反应的氧气的体积为x,则:
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
2 1 2
2x x 2x
根据反应前后剩余的氧气的质量相等得:
aL-(2x+x)=bL-2x
解得:x=(a-b)L;
所以原混合气体中氧气的体积为:aL-2x=aL-2(a-b)L=(2b-a)L,含氢气体积=aL-(2b-a)L=2(a-b)L;
故答案为:2(a-b).
点评 本题难度中等,考查新信息的获取能力、处理能力及灵活运用进行解题的能力,注意过量计算的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
3.下列说法或表示错误的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
4.工业上常用铁质容器盛装冷浓硫酸,为研究铁材料与热浓硫酸的反应,某学习小组称取铁钉6.0g放入15.0mL浓硫酸中,加热.充分反应后得到溶液X并收集到气体Y.甲同学认为X中除含Fe3+外还可能含有Fe2+.若要确认其中Fe2+,应选用( )
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
5.化学反应原理模块中涉及很多常数,下列说法中不正确的是( )
| A. | 对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 | |
| B. | 化学反应速率常数k与浓度无关,但受温度、催化剂、固体表面性质等因素的影响 | |
| C. | 水的离子积常数Kw、电离平衡常数Ka与温度有关,不受溶液的酸碱性影响 | |
| D. | 溶度积常数Ksp与难溶电解质的性质和温度无关,只与沉淀的量有关 |
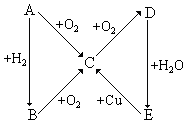 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
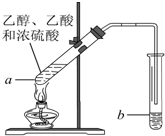 在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题: