题目内容
1.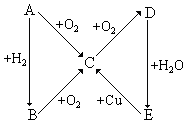 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.(1)当A是气体单质时,A是N2,B是NH3,C是NO,D是NO2,E是HNO3.
(2)当A是固体单质时,A是S,B是H2S,C是SO2,D是SO3,E是H2SO4.
分析 (1)当A是气体单质时,A能与氧气、氢气反应,且B能发生连续氧化反应,D能和Cu反应生成C,则E为硝酸,所以A为N2,B为NH3,C为NO,D为NO2,E为HNO3,
(2)如果A是固体单质,E为酸,能和Cu反应生成C,则E是硫酸,A为S、B为H2S、C为SO2、D为SO3,据此分析解答.
解答 解:(1)当A是气体单质时,A能与氧气、氢气反应,且B能发生连续氧化反应,D能和Cu反应生成C,则E为硝酸,A为氮气,A和氢气反应生成B为氨气,A和氧气反应生成C为NO,CO被氧气氧化生成D为二氧化氮,二氧化氮和水反应生成硝酸E,所以A为N2,B为NH3,C为NO,D为NO2,E为HNO3,A、B、C、D、E分别是N2、NH3、NO、NO2、HNO3,
故答案为:N2;NH3;NO;NO2;HNO3;
(2)如果A是固体单质,E为酸,能和Cu反应生成C,则E是硫酸,则A为S,A和氢气反应生成B为H2S,A和氧气反应生成C为SO2,C被氧气氧化生成D为SO3,
故答案为:S;H2S;SO2;SO3;H2SO4.
点评 本题以S、N以上及其化合物之间的转化为载体考查无机物推断,为高频考点,以Cu和酸的反应为突破口进行推断,侧重考查学生分析推断及知识综合运用能力,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.有以下四种微粒14N、15N、N2、N4(结构为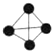 ),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 ),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 1molN4气体完全转变为N2将放出882kJ热量 | |
| B. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| C. | N4属于一种新型的化合物 | |
| D. | 14N与15N化学性质不相同 |
9.下列四组物质中,前者属于电解质,后者属于非电解质的是( )
| A. | 二氧化碳 碳酸钠 | B. | 硫酸钠 乙醇 | ||
| C. | 氧化铝 硫 | D. | 盐酸 蔗糖 |
4.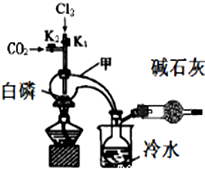 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.实验室制取PCl3的装置示意图和有关数据如下:
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶、分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可);(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是在甲中先加入白磷,再通入CO2到排尽甲中的空气,向甲中通入Cl2,加热.
(3)E烧杯中加入冷水的目的是冷却PCl3,使其液化,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)
(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶、分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可);(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是在甲中先加入白磷,再通入CO2到排尽甲中的空气,向甲中通入Cl2,加热.
(3)E烧杯中加入冷水的目的是冷却PCl3,使其液化,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)
(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.