题目内容
10.为了强化安全管理,从油库引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )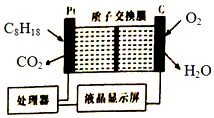
| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+ | |
| C. | H+由质子交换膜左侧向右侧迁移 | |
| D. | 每消耗5.6LO2,电路中通过1 mol电子 |
分析 该原电池中,铂电极上C8H18失电子发生氧化反应而作负极,电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+,石墨作正极,正极上氧气得电子发生还原反应,电极反应式:4H++O2+4e-═2H2O,在原电池中,阳离子移向正极,据此分析判断.
解答 解:A.石墨作正极,正极上氧气得电子发生还原反应,故A正确;
B.铂电极上C8H18失电子发生氧化反应而作负极,电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+,故B正确;
C.阳离子移向正极,所以H+由质子交换膜左侧向右侧迁移,故C正确;
D.未指明标准状况下,无法计算,故D错误;
故选D.
点评 本题考查了原电池原理,根据电极反应式中元素化合价变化来确定正负极,结合正负极反应式判断,难度不大.

练习册系列答案
相关题目
6. 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:
由此回答以下问题:
(1)Y元素在周期表中的位置是第二周期ⅤA族,其单质的电子式是 .
.
(2)W最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是H2S?H++HS-.
(3)X、Y、Z组成的某种盐的水溶液pH<7,其原因用化学用语解释是NH4++H2O?NH3•H2O+H+,在该溶液中各种离子浓度的大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
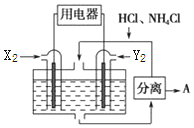
(4)用适当催化剂及电极材料,以HCl一NH4Cl为电解质溶液,构成如图所示的新型电池.
Ⅰ.该电池的正极反应式是N2+8H++6e-=2NH4+.
Ⅱ.分离出物质A的化学式是NH4Cl.
 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:| 元素 | 信息 |
| X | 原子半径最小 |
| Y | 单质在空气中含量最高 |
| Z | 其最外层电子数是电子层数的3倍 |
| W | 最高正价与最低负价的代数和为4 |
(1)Y元素在周期表中的位置是第二周期ⅤA族,其单质的电子式是
 .
.(2)W最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是H2S?H++HS-.
(3)X、Y、Z组成的某种盐的水溶液pH<7,其原因用化学用语解释是NH4++H2O?NH3•H2O+H+,在该溶液中各种离子浓度的大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(4)用适当催化剂及电极材料,以HCl一NH4Cl为电解质溶液,构成如图所示的新型电池.
Ⅰ.该电池的正极反应式是N2+8H++6e-=2NH4+.
Ⅱ.分离出物质A的化学式是NH4Cl.
15.常温下,下列叙述正确的是( )
| A. | NaHCO3 溶液的pH=8,则溶液中:c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10 mL pH=12 的氢氧化钠溶液中加入pH=2 的HA 溶液至pH 恰好等于7,所得溶液的总体积一定等于20 mL | |
| D. | 浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,c(NH4+)大小顺序为②>③>① |
2.下列有关物质性质和用途具有对应关系的是( )
| A. | 二氧化硅熔点高,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥气体 | |
| C. | 次氯酸钙具有强氧化性,可用于消毒杀菌 | |
| D. | 氯化铁易水解,可用于腐蚀铜制线路板 |
20.已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 4.6g乙醇含有共价键的数目为0.9NA |
 如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)
如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)



 ;分子M发生加聚反应产物的结构简式
;分子M发生加聚反应产物的结构简式 .
.