题目内容
 锌与不同浓度的硫酸反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为101kPa,温度为0℃):
锌与不同浓度的硫酸反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为101kPa,温度为0℃):(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,在洗气瓶中加入1 mol/L NaOH溶液的体积V≥
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重1.28g,则发生反应的化学方程式为:
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到V mL气体,则有:
| a |
| 65 |
| b |
| 64+V |
| V |
| 22400 |
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,
| n(H2) |
| n(SO2) |
考点:浓硫酸的性质实验
专题:实验题
分析:(1)根据锌的质量计算生成气体的体积,从而确定氢氧化钠的体积和量气管的适宜规格;
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式;
(3)根据氧化还原反应的特点分析;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量.
(2)根据氢氧化钠的性质分析增重的原因,并写出相应的化学反应方程式;
(3)根据氧化还原反应的特点分析;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量.
解答:
解:(1)为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液除去二氧化硫,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
1 1
0.02mol
SO2 +NaOH=NaHSO3;
0.02mol 0.02mol
需要1mol/L NaOH溶液的体积最少为
=0.02L,即V≥20ml;
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.448L
0.448L=448mL,故选500mL的量筒,
故答案为:20;500mL;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,由(1)计算可知,1.30g锌和硫酸反应若只生成二氧化硫,共生成0.02mol,质量为0.02mol×64g/mol=1.28g,和氢氧化钠增重吻合,故发生反应的化学方程式为:
Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O;
(3)根据氧化还原反应中得失电子数相等列出式子.若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到Vml气体,
则依据化学反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
由电子守恒列式计算有:ag/65g?mol-1×2=
×2+
×2,
得到
=
+
,故答案为:得失电子守恒;
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
mol
mol
生成二氧化硫需要的硫酸为
mol;
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
(cV-
)mol (cV-
)mol
=
=
,
故答案为:
.
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
1 1
| 1.30g |
| 65g/mol |
SO2 +NaOH=NaHSO3;
0.02mol 0.02mol
需要1mol/L NaOH溶液的体积最少为
| 0.02mol |
| 1mol/L |
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
| 1.30g |
| 65g/mol |
0.448L=448mL,故选500mL的量筒,
故答案为:20;500mL;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,由(1)计算可知,1.30g锌和硫酸反应若只生成二氧化硫,共生成0.02mol,质量为0.02mol×64g/mol=1.28g,和氢氧化钠增重吻合,故发生反应的化学方程式为:
Zn+2H2SO4(浓)
| ||
故答案为:Zn+2H2SO4(浓)
| ||
(3)根据氧化还原反应中得失电子数相等列出式子.若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到Vml气体,
则依据化学反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
由电子守恒列式计算有:ag/65g?mol-1×2=
| bg |
| 64g/mol |
| VmL |
| 22400mL/mol |
得到
| a |
| 65 |
| b |
| 64 |
| V |
| 22400 |
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
| m |
| 32 |
| m |
| 64 |
生成二氧化硫需要的硫酸为
| m |
| 32 |
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
(cV-
| m |
| 32 |
| m |
| 32 |
| n(H2) |
| n(SO2) |
cV-
| ||
|
| 64cV-2m |
| m |
故答案为:
| 64cV-2m |
| m |
点评:本题考查了浓硫酸的性质和排气量气装置,要注意的是锌和硫酸的反应,硫酸浓度不同时,锌和硫酸反应的生成物不同,表现氧化性的元素也不同,题目难度中等,计算较多,注意注意把握实验原理和守恒原理的应用.

练习册系列答案
相关题目
浊液区别于其他分散系最本质的特征是( )
| A、外观混浊不清 |
| B、分散质粒子不能透过半透膜 |
| C、不稳定 |
| D、分散质粒子直径大于10-7m |
下列图示与对应的叙述相符的是( )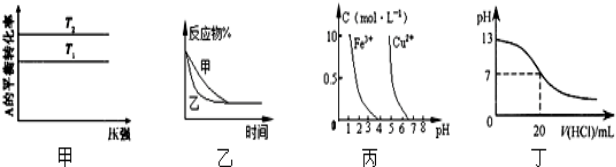

| A、图甲可以判断出反应A(g)+B(g)?2C(g)的△H<0,T2>T1 |
| B、图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量的CuO,调节pH≈4 |
| D、图丁表示25℃时,用0.1 mol/L 盐酸滴定20 ml 0.1mol/LNaOH溶液,溶液的pH随加入盐酸体积的变化 |
已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
| A、铍的金属性比钠强 |
| B、氯化锂的氧化性比氯化铍强 |
| C、氢氧化铍的碱性比氢氧化钙的弱 |
| D、单质铍易跟冷水反应产生氢气 |
下列关于砷(As)元素的叙述中,正确的是( )
| A、在AsCl3分子中,砷原子最外层电子数为8 |
| B、Na3AsO4溶液的pH等于7 |
| C、砷的氢化物的化学式为AsH3,其还原性比NH3的弱 |
| D、第一电离能:As<Se |
下列物质不能通过化合反应制得的是( )
| A、Fe(OH)2 |
| B、Fe(OH)3 |
| C、CaSiO3 |
| D、Fe(NO3)3 |
