题目内容
16.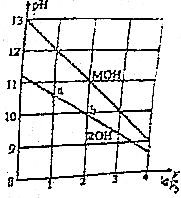 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |
分析 A.根据0.1mol/L的ROH溶液的pH判断电解质强弱,然后写出电离方程式;
B.弱电解质在水溶液中随着浓度的减小其电离程度增大;
C.根据图象可知,浓度相同时MOH溶液的pH大于ROH,说明MOH的碱性大于ROH;
D.MOH的碱性强于ROH的碱性,当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,促进弱电解质电离.
解答 解:A.根据图象可知,0.1mol/L的ROH溶液的pH<12,说明ROH在溶液中部分电离出氢氧根离子,为弱电解质,则ROH正确的电离方程式为:ROH?R++OH-,故A错误;
B.由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,故B正确;
C.根据图象曲线可知,浓度相同时MOH溶液的pH大于ROH,说明MOH的碱性大于ROH,则等pH时ROH的浓度大于MOH,即:MOH的浓度低,故C正确;
D.根据A知,碱性MOH>ROH,当lg$\frac{V}{{V}_{0}}$=2时,由于ROH是弱电解质,升高温度能促进ROH的电离,则c(R+)增大;而MOH为强电解质,完全电离,则其浓度c(M+)不变,故D正确;
故选A.
点评 本题考查溶液pH计算与判断,为高频考点,题目难度中等,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,注意熟练掌握溶液酸碱性与溶液pH的关系及计算方法.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{8}$ |
| A. | 实验结果随反应物用量改变而改变 | |
| B. | 实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和 | |
| C. | 实验中不可用环形铜质搅拌棒代替环形玻璃搅拌棒 |
| A. | 2:3 | B. | 1:3 | C. | 1:4 | D. | 2:5 |
下列实验方案,不能达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
B | 验证氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入稀硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
C | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
D | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |

 .
.