题目内容
7.某温度时,测得0.1mol/LNaOH溶液的pH为11,则该温度下水的Kw=1×10-12.此温度下,将pH=10的NaOH溶液a mL与pH=2的HCl溶液bmL混合,所得溶液恰好呈中性,则a:b=1:1.分析 (1)根据溶液的pH计算出溶液中的氢离子浓度,再计算出水的离子积;
(2)根据酸碱中和反应后溶液为中性,氢离子和氢氧根离子物质的量相等,计算出二者体积关系.
解答 解:(1)该温度下,0.1mol/L NaOH溶液的pH为11,溶液中氢离子浓度为10-11mol/L,温度下水的KW=0.1×10-11=1×10-12故答案为:1×10-12;
(2)pH=10的NaOH溶液,氢氧根离子的浓度为:10-2mol/L,氢氧化钠的物质的量为:10-2mol/L×aL=0.01amol,
pH=2的HCl溶液中氢离子物质的量为:0.01bmol,混合后溶液为中性,即0.01amol=0.01bmol,解得a:b=1:1,
故答案为:1:1.
点评 本题考查了水的离子积、酸碱中和反应的计算等知识,可以根据所学知识完成,本题难度不大.

练习册系列答案
相关题目
17.下列物质不属于高分子材料的是( )
| A. | 蛋白质 | B. | 纤维素 | C. | 淀粉 | D. | 油脂 |
18.A和B两种有机物可以互溶,其有关性质如表所示:

(1)要除去A、B混合物中的少量A,可采用A方法即可得到B.
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.
| C)°密度(20 | 熔点 | 沸点 | 熔解性 | |
| A | 0.713 7g•cm3- | C°-116.3 | C°34.5 | 不溶于水 |
| B | 0.789 3g•cm3- | C°-117.3 | C°78.5 | 与水以任意比混溶 |

(1)要除去A、B混合物中的少量A,可采用A方法即可得到B.
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种不同化学环境的氢原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.
15.青石棉是一种致癌物质,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是( )
| A. | 1 mol青石棉能使1 mol稀硝酸被还原 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉属于新型无机非金属材料 | |
| D. | 青石棉不属于硅酸盐原料 |
12.25℃时,将0.1mo1•L-1氨水与0.1mo1•L-1盐酸按不同比例混合(如表)所得溶液中微粒间关系不正确( )
| 编号 | ① | ② | ③ | ④ |
| 氨水体积/mL | 40 | V1 | 30 | 20 |
| 盐酸体积/mL | 20 | 60-V1 | 30 | 40 |
| A. | ①所得溶液中,c(NH4+)>c(C1-)>c(NH2•H2O)>c(OH-)>c(H+) | |
| B. | 若②所得溶液pH=7,则c(NH4+)=c(C1-)=1×10-7mo1•L-1 | |
| C. | ③所得溶液中.c(H+)-c(OH-)=c(NH3•H2O) | |
| D. | ④所得溶液中,c(C1-)=2c(NH3•H2O)+2c(NH4+) |
16.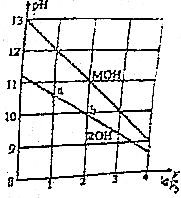 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |
 .
.